L'abbassamento della tensione di vapore
Quando un solvente entra a contatto con un soluto non volatile si verifica un abbassamento della tensione di vapore del solvente Psolvente rispetto alla tensione di vapore del solvente liquido puro , proporzionale alla frazione molare del soluto Xsoluto nella soluzione. $$ P_{solvente} = P_{solvente \: puro} \cdot X_{soluto} $$
La pressione di vapore (p) di una soluzione diluita con un soluto non volatile (B) nel solvente (A) è inferiore alla pressione di vapore del solvente allo stato puro (p0).
$$ \frac{p-p_0}{p_0} = x_B = \frac{n_B}{n_A+n_B} $$
$$ \frac{ \Delta p}{p_0} = x_B = \frac{n_B}{n_A+n_B} $$
Dove nA e nB sono i numeri di moli del solvente (A) e del soluto (B) nella soluzione.
Nota. Essendo xA+xB=1 la formula posso scriverla anche in questo modo equivalente in relazione alla frazione molare del solvente xA $$ \frac{\Delta p}{p_0} = x_A = \frac{n_A}{n_A+n_B} $$
Se la soluzione è molto diluita (xB<<1), allora il numero di moli del soluto è molto più basso del solvente ossia nB << nA.
In questo caso la formula posso approssimarla omettendo nB al denominatore
$$ \frac{ \Delta p}{p_0} = \frac{n_B}{n_A} $$
Ne consegue che l'abbassamento della tensione di vapore Δp è proporzionale al numero di moli del soluto nB.
$$ \Delta p = \frac{n_B}{n_A} p_0 $$
L'abbassamento della tensione di vapore del solvente in una soluzione dipende dalle frazioni molari del solvente e del soluto ed è indipendente dalla loro natura chimica.
E' una delle proprietà colligative delle soluzioni, ossia indipendenti dalla natura chimica del solvente e del soluto.
Le proprietà colligative dipendono esclusivamente dalle quantità di particelle del soluto e del solvente.
La spiegazione
Una soluzione è composta da particelle di solvente e di soluto.
Quando il soluto non è volatile ha una tensione di vapore trascurabile, molto inferiore a quella del solvente.
Pertanto, con l'aumentare delle particelle di soluto nella soluzione, le particelle del solvente hanno minore possibilità di evaporare rispetto al solvente puro.
Un esempio pratico
Il diagramma di stato dell'acqua come liquido puro è il seguente:
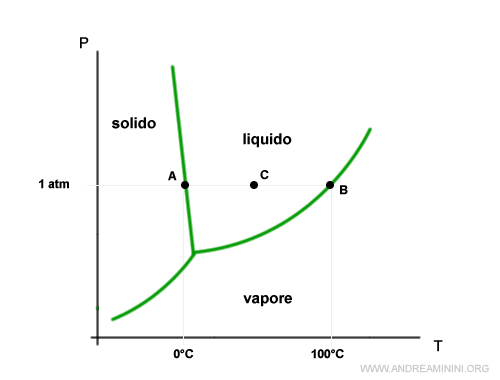
La tensione vapore è la curva di confine tra la regione del vapore e quella del liquido.
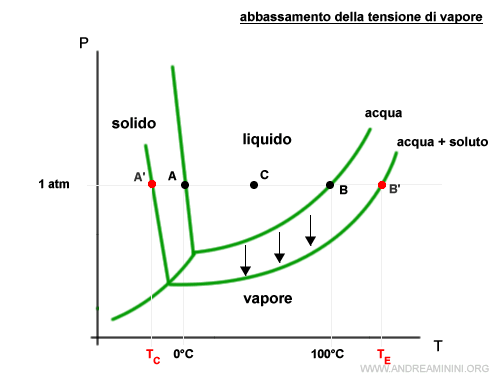
Quando l'acqua entra a contatto con un soluto si verifica un abbassamento della tensione vapore della soluzione.
A parità di pressione (1 atm) il punto di congelamento TC si riduce mentre il punto di ebollizione TE aumenta.
Nota. Pertanto, la temperatura di congelamento della soluzione è inferiore a quella del solvente puro.
L'abbassamento del punto di congelamento Tc è detto abbassamento crioscopico e si calcola con la seguente formula:
$$ \Delta T_{C} = K_{cr} m $$
Dove m è la molalità della soluzione mentre Kcr è la costante crioscopica che rappresenta l'abbassamento della temperatura di congelamento in una quantità m della soluzione rispetto al solvente puro.
Ogni solvente ha una propria costante crioscopica caratteristica
Esempio. La costante crioscopica dell'acqua è Kcr = 1,86 °C kg/mol. Pertanto, una mole di soluto disciolta in 1000 grammi d'acqua causa un abbassamento della temperatura di congelamento di 1,86°C della soluzione rispetto all'acqua pura. Nel caso del benzene è Kcr = 5,12 °C kg/mol.
Ne consegue che l'abbassamento della temperatura di congelamento (o solidificazione) è proporzionale alla molalità (m) della soluzione.
L'aumento della temperatura di ebollizione della soluzione è detta innalzamento ebullioscopico e si calcola in modo simile.
$$ \Delta T_{E} = K_{eb} m $$
Dove m è la molalità della soluzione mentre Keb è la costante ebullioscopica che rappresenta l'aumento della temperatura di ebollizione in una quantità m della soluzione rispetto al solvente puro.
Ogni solvente ha una propria costante ebullioscopica caratteristica
Esempio. La costante ebullioscopica dell'acqua è Keb = 0,52 °C kg/mol. Pertanto, una mole di soluto (1 mol) disciolta in 1000 grammi d'acqua causa un incremento della temperatura di ebollizione di 0,52°C della soluzione rispetto al solvente puro (acqua). Nel caso del benzene è Keb = 2,53 °C kg/mol.
Ne consegue che l'aumento della temperatura di ebollizione è proporzionale alla molalità (m) della soluzione.
La dimostrazione
La dimostrazione comincia dalla legge di Raoult che esprime la pressione P della soluzione come somma delle pressioni parziali del solvente (A) e del soluto (B).
$$ P = P_A + P_B $$
Considerando le tensioni di vapore del solvente e del soluto P*A e P*B come sostanze pure (non mescolate), a parità di temperatura, posso riscrivere la legge in questo modo:
$$ P = P*_Ax_A + P*_Bx_B $$
Dove xA e xB sono le rispettive frazioni molari del solvente (A) e del soluto (B) nella soluzione.
Se il soluto (B) è un solido la tensione vapore pB è trascurabile. Quindi, ometto il secondo termine per semplicità.
$$ P = P*_Ax_A $$
La somma delle frazioni molari del solvente e del soluto è uguale a 1.
$$ x_A + x_B = 1 $$
Questo mi permette di calcolare la frazione molare del solvente per differenza.
$$ x_A = 1 - x-B $$
Ora sostituisco xA nella formula di Raoult
$$ P = P*_Ax_A $$
$$ P = P*_A(1-x_B) $$
$$ P = P*_A-P*_Ax_B) $$
$$ P - P*_A = -P*_Ax_B $$
$$ P*_A - P = P*_Ax_B $$
$$ \frac{P*_A - P}{P*_A} = x_B $$
In questo modo ottengo la formula dell'abbassamento relativo della tensione di vapore del solvente
$$ \frac{\Delta P}{P*_A} = x_B $$
Dove ΔP misura la differenza tra la tensione di vapore del solvente liquido puro (P*A) e della soluzione (P).
In conclusione, l'abbassamento della tensione di vapore della soluzione dipende dalle frazioni molari del solvente xA e del soluto xB ed è indipendente dalla loro natura chimica.
Una spiegazione alternativa
Dal punto di vista grafico il fenomeno è più chiaro.
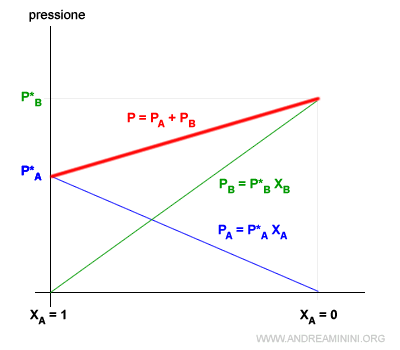
La pressione della soluzione P è uguale alla somma della pressione del solvente PA e del soluto PB a parità di temperatura.
Quando il solvente (A) è un liquido puro la frazione molare è XA=1. In questo caso non c'è nemmeno una particella di soluto.
Se il solvente è un liquido puro, la sua tensione di vapore è P*A.
Quando aggiungo il soluto (B) al solvente (A), la frazione molare del solvente si riduce XA<1.
Secondo la legge di Raoult la riduzione della frazione molare riduce la tensione vapore del solvente PA.
$$ P_A = P*_A x_A $$
Questo spiega l'abbassamento della tensione di vapore del solvente in una soluzione all'aumentare della frazione molare del soluto.
E così via.
