Gli orbitali ibridi sp2
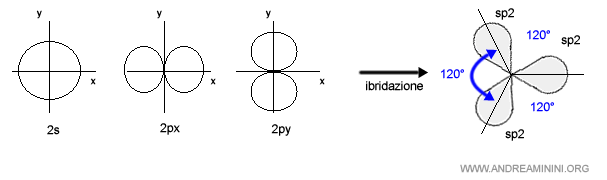
L'ibridazione sp2 degli orbitali atomici è il rimescolamento degli elettroni dell'orbitale s e di due orbitali p per formare tre orbitali ibridi equivalenti.
L'ibridazione sp2 modifica la forma e le proprietà della configurazione elettronica.
Grazie al processo di ibridazione, l'atomo può formare tre legami chimici.
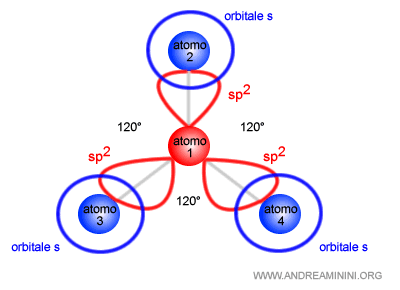
Gli orbitali sp2 si dispongono sul piano con i lobi verso i vertici del piano, con un angolo di 120°, formando un triangolo equilatero.
Per questa ragione gli orbitali ibridi sp2 sono anche detti ibridi trigonali.
Un esempio pratico
La molecola BH3 si forma tramite un processo di ibridazione.
Allo stato fondamentale un atomo di boro (B) ha la configurazione elettronica 2s2 2p1
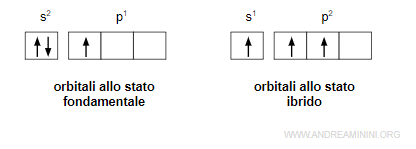
Nell'ibridazione sp2 un elettrone dell'orbitale s viene promosso su un orbitale di tipo p per ottenere i tre elettroni spaiati che giustificano la trivalenza del boro.
Quindi, allo stato ibrido l'atomo di boro può legarsi con altri tre atomi di idrogeno.
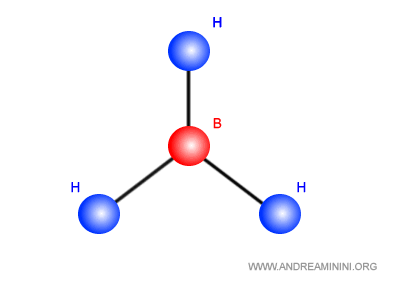
I legami della molecola si ottengono per sovrapposizione degli orbitali sp2 del boro (B) con gli orbitali s1 dell'idrogeno (H).
E così via.
