Ibridazione sp3
Cos'è l'ibridazione sp3
L'ibridazione sp3 è la combinazione di un orbitale di tipo s con tre orbitali di tipo p che dà origine a quattro orbitali ibridi sp3.
E' uno dei principali passaggi elettronici degli orbitali dallo stato fondamentale allo stato ibrido.
Si verifica quando l'atomo viene eccitato da un'energia esterna, detta energia di ibridazione, che causa il salto di un elettrone dall'orbitale s all'orbitale p.
Gli orbitali ibridi sp3 hanno forma e proprietà diverse rispetto agli orbitali s e p.
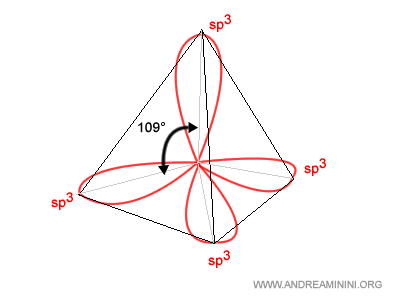
L'ibridazione dispone i quattro orbitali sp3 nello spazio in modo che abbiano un angolo di legame di circa 109° l'uno dall'altro, dando alla molecola la figura di un tetraedro regolare.
Gli orbitali sp3 sono anche detti ibridi tetraedrici.
Nota. L'angolo degli orbitali sp3 può scendere a 107° o 104° se nella molecola sono presenti doppietti solitari (lone pair) che aumentano la repulsione tra i doppietti di legame degli orbitali sp3.
Un esempio pratico
La configurazione elettronica di un atomo di carbonio (C) allo stato fondamentale è 2s2 2p2
Questo potrebbe far pensare che il carbonio forma al massimo due legami chimici con gli altri elementi, generando molecole del tipo CX2.
In realtà, spesso il carbonio si lega con più di due atomi.
Questo accade perché l'atomo di carbonio viene modificato da un processo di ibridazione che sposta un elettrone dall'orbitale 2s su un orbitale 2p.
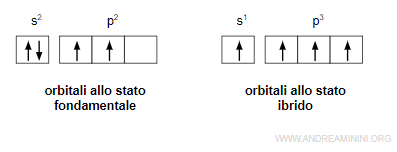
Nota. Lo stato elettronico eccitato deriva dal fatto che gli orbitali 2s e 2p sono abbastanza vicini come livello energetico. Quindi, una minima eccitazione (circa 400kJ/mol) produce il salto di un elettrone dall'orbitale s all'orbitale p a maggiore energia.
In questo modo, ogni orbitale ha un solo elettrone di valenza e l'atomo eccitato di carbonio C* può formare quattro legami covalenti con altri atomi.
Ad esempio, può formare quattro coppie di legame con quattro atomi di idrogeno, dando vita alla molecola di metano CH4.
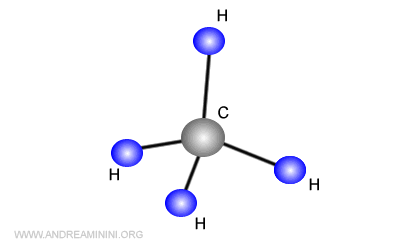
Nella molecola di metano, un legame CH nasce dalla sovrapposizione dell'orbitale 1s dell'idrogeno con l'orbitale 2s del carbonio.
Gli altri tre legami CH nascono dalla sovrapposizione degli orbitali 1s di tre atomi di idrogeno, con i tre orbitali 2p dell'atomo di carbonio eccitato C*.
I quattro nuovi orbitali sono equivalenti e si dispongono in modo simmetrico intorno all'atomo di carbonio posto al centro della molecola.
Nota. La forma della molecola di metano CH4 è un tetraedro regolare con angoli di 109°. Pertanto, viene meno la differenza tra orbitali s e orbitali p. Allo stato ibrido gli orbitali del metano sono equivalenti tra loro.
E così via.
