Le reazioni ossidoriduzione
Cosa sono le reazioni di ossido-riduzione
Le reazioni chimiche di ossido-riduzione (redox) sono reazioni in cui gli elementi cambiano il proprio numero di ossidazione.
- Ossidazione
L'elemento che aumenta il proprio numero di ossidazione (si ossida) cede elettroni ad altri atomi. E' detto riducente, perché causa la riduzione del numero di ossidazione di un altro elemento.
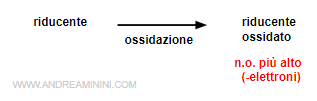
- Riduzione
L'elemento che riduce il proprio numero di ossidazione (si riduce) acquista elettroni da altri atomi. E' detto ossidante, perché causa l'ossidazione di un altro elemento.
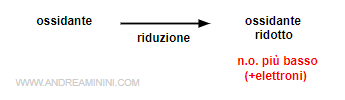
Nota. Il numero di ossidazione (n.o.) indica la carica formale di un elemento. Se un atomo perde un elettrone (-e-), l'atomo assume una carica elettrica positiva (+1) perché il numero di protoni è maggiore degli elettroni. Per questa ragione il suo numero di ossidazione aumenta quando l'atomo perde gli elettroni. E viceversa.
Le reazioni di ossidazione e di riduzione sono strettamente legate tra loro, perché un'ossidazione (cessione elettrone) causa una riduzione (acquisto elettrone).
Per questa ragione si parla di reazione di ossido-riduzione o redox (reduction oxidation).
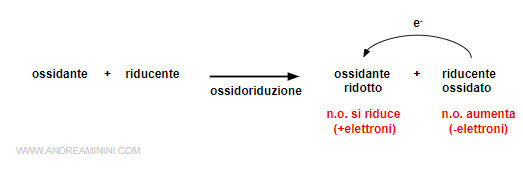
Alcuni elettroni passano da un elemento chimico a un altro.
Gli elettroni non si trovano liberi, quindi un atomo per aumentare il proprio numero di elettroni deve prenderli ad altri atomi.
Perché si dice ossidoriduzione? In passato il termine "ossidazione" indicava soltanto le reazioni che permettevano a una sostanza di legarsi con l'ossigeno mentre il termine "riduzione" le reazioni in cui una sostanza perdeva il legame con l'ossigeno. Oggi il significato di ossidoriduzione è più ampio, riguarda la proprietà di un elemento chimico di perdere o acquisire elettroni, ossia variare il proprio numero di ossidazione, quando si lega a qualsiasi altro elemento (non più solo con l'ossigeno).
Un esempio pratico
Questa reazione chimica è di ossidoriduzione perché alcuni elementi cambiano il proprio numero di ossidazione.
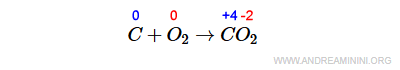
L'atomo di carbonio (C) si ossida perché aumenta il proprio n.o. da zero a +4.
L'atomo di ossigeno (O) si riduce perché il proprio n.o. diminuisce da zero a -2.
Nota. Per essere classificata come redox non occorre che tutti gli elementi della reazione cambino il proprio numero di ossidazione.
Quindi, il carbonio (C) è la sostanza riducente perché riduce il n.o. dell'ossigeno.
L'ossigeno (O) è, invece, la sostanza ossidante perché ossida il carbonio, ossia aumenta il numero di ossidazione del carbonio.
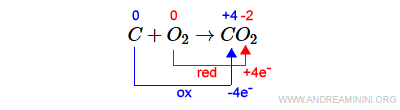
Nota. In questo caso il carbonio cede 4 elettroni agli atomi di ossigeno che, essendo due atomi, acquiscono ciascuno 2 elettroni. Per questa ragione il n.o. dell'ossigeno scende a -2.
Le semireazioni di ossidoriduzione
Posso scomporre una reazione redox in due semireazioni di ossidazione e di riduzione.
La somma delle semireazioni è uguale alla reazione redox.
A cosa serve la scomposizione? Posso bilanciare separatamente le due semireazioni. Lavorare su due semireazioni è meno complesso che farlo sull'equazione redox originaria. Poi sommo le due semireazioni bilanciate per ricomporre l'equazione redox bilanciata.
Esempio
In questa reazione chimica il ferro (Fe) riduce il proprio numero di ossidazione mentre il rame (Cu) lo aumenta.
Pertanto, il ferro si ossida mentre il rame si riduce.
$$ Cu + Fe^{3+} \rightarrow Cu^{2+} + Fe^{2+} $$
Suddivido l'equazione chimica in due equazioni per rappresentare separatamente la semireazione di ossidazione e di riduzione.
$$ Cu \rightarrow Cu^{2+} $$
$$ Fe^{3+} \rightarrow Fe^{2+} $$
Guardando le semireazioni è subito evidente il processo di ossidoriduzione.
- La prima è la semireazione di ossidazione perché il n.o. del rame (Cu) aumenta
- La seconda è la semireazione di riduzione perché il n.o. del ferro (Fe) diminuisce.
A questo punto posso bilanciare separatamente le due semireazioni in modo più semplice e immediato.
Nota. Il rame (Cu) ha un atomo tra i reagenti e un atomo nei prodotti. Lo stesso accade per il ferro (Fe). Quindi, la massa è bilanciata in entrambe le semireazioni. Il numero degli elettroni, invece, è ancora da bilanciare perché Il rame (Cu) perde due elettroni mentre il ferro (Fe) ne acquista uno.$$ Cu \rightarrow Cu^{2+} + 2e^- $$ $$ Fe^{3+} + e^- \rightarrow Fe^{2+} $$ Per vedere la soluzione del bilanciamento rimando all'esempio nei miei appunti sul metodo di bilanciamento delle semireazioni.
Come bilanciare una reazione redox
Posso bilanciare un'equazione chimica di tipo redox usando alternativamente due metodi:
- Metodo della variazione del numero di ossidazione
Analizzo le variazioni del numero di ossidazione in ogni specie dell'equazione chimica. Modifico i coefficienti stechiometrici per fare in modo che il numero di elettroni ceduti sia uguale al numero degli elettroni acquisiti. Una volta bilanciate le cariche elettriche, bilancio le masse. - Metodo delle semireazioni
Scompongo la reazione in due semireazioni di ossidazione e di riduzione. Poi le bilancio separatamente. Infine, le sommo per ricomporre l'equazione redox bilanciata.
I due metodi sono alternativi tra loro.
Per bilanciare un'equazione redox si può usare l'uno o l'altro.
Quale metodo è meglio usare? Personalmente, uso il primo metodo di bilanciamento perché lo ritengo più rapido. Tuttavia, se l'equazione è molto complessa è meglio usare il secondo perché suddivide il problema del bilanciamento in due sottoproblemi da risolvere separatamente.
E così via.
