Tipi di reazioni chimiche
Le principali tipologie di reazioni chimiche sono le seguenti:
Reazione di sintesi
In una reazione di sintesi due o più sostanze reagenti (elementi o composti) si combinano tra loro formando un prodotto composto. $$ A+B \rightarrow AB $$
Alcune reazioni di sintesi tipiche
| Reagenti | Prodotti |
|---|---|
| Metallo + Non metallo | Sale |
| Metallo + Ossigeno | Ossido basico |
| Non metallo + Ossigeno | Ossido acido |
| Ossido basico + Acqua | Idrossido (o base) |
| Ossido acido + Acqua | Ossiacido |
Esempio
Un esempio tipico di reazione di sintesi è la combustione, in cui un atomo di carbonio (C) e una molecola di ossigeno (O2) si combinano in una molecola di diossido di carbonio (CO2).
$$ C + O_2 \rightarrow CO_2 $$
Reazione di decomposizione (o scissione)
In una reazione di decomposizione una sostanza composta si decompone in due o più sostanze più semplici. $$ AB \rightarrow A+B $$
Si tratta di una reazione inversa rispetto alla sintesi.
Spesso le reazioni di decomposizione avvengono per riscaldamento di una sostanza.
Esempio
I sali formati da ioni poliatomici si scindono per riscaldamento, formando un ossido basico del metallo e un ossido acido del non metallo.
$$ CaCO_3 \rightarrow CaO + CO_2 $$
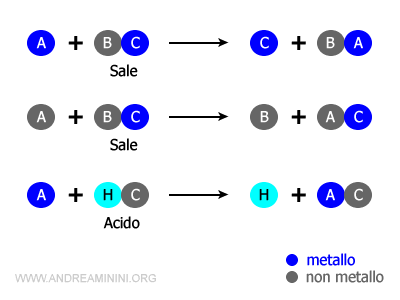
Reazione di spostamento (o di scambio)
In una reazione di spostamento uno o più elementi si spostano da una sostanza a un'altra. $$ A + BC \rightarrow AB+C $$
E' anche detta reazione di sostituzione semplice.
- Un atomo metallico si sostituisce a uno ione metallico in un sale
- Un atomo non metallico si sostituisce a uno ione non metallico in un sale
- Un atomo metallico si sostituisce all'idrogeno in un acido
Se due composti si scambiano delle sostanze si parla di reazione di doppio scambio.
In genere le reazioni di doppio scambio avvengono tra due sali.
Esempio
Un atomo metallico si sostituisce a uno ione metallico in un sale o dell'idrogeno in un acido.
$$ Cu + AgNO_3 \rightarrow CuNO_3 + Ag $$
Esempio 2
Questa è, invece, una reazione di doppio scambio tra due composti.
$$ AgNO_4 + NaCl \rightarrow NaNO_3 + AgCl \downarrow $$
In questo caso si tratta anche di una reazione di precipitazione.
Reazione di precipitazione. Se da due reagenti solubili si forma un composto insolubile si parla di reazione di precipitazione. Il composto insolubile è detto precipitato, perché precipita sul fondo del recipiente, e si indica con una freccia verso il basso. $$ AgNO_4 + NaCl \rightarrow NaNO_3 + AgCl \downarrow $$
Esempio 3
Anche questa reazione è di doppio scambio tra H e K.
$$ 2HCl + K_2 S \rightarrow H_2S \uparrow + 2KCl $$
In questo caso la reazione libera una sostanza gassosa nel prodotto, è indicata con la freccia in su.
Reazione di doppio scambio ionico
In una reazione di doppio scambio ionico i composti reagenti in una soluzione si scambiano tra loro degli ioni. $$ AB + CD \rightarrow AC+BD $$
Esempio
La reazione di doppio scambio tra due sali
$$ AgNO_3 + NaCl \rightarrow NaNO_3 + AgCl $$
Reazione di neutralizzazione (o acido-base)
In una reazione di neutralizzazione un acido e un base si combinano tra loro in una soluzione, formando sali e acqua. $$ HA + BOH \rightarrow AB+H_2O $$
Esempio
La netralizzazione tra un acido (HCl) e un idrossido (LiOH) forma un sale e l'acqua.
$$ HCl + LiOH \rightarrow LiCl + H_2O $$
La parte non metallica dell'acido (Cl) e quella metallica dell'idrossido (Li) si combinano tra loro in un sale.
Reazione di dissociazione ionica
In una reazione di dissociazione ionica acidi o basi si scompongono in ioni $$ AB \rightarrow A^+ + B^- $$
Generalmente si verifica in un ambiente acquoso.
Esempio
In una soluzione acquosa l'acido cloridrico HCl si scompone in uno ione positivo di idrogeno e in uno ione negativo di cloro.
$$ HCl_{(aq)} \rightarrow H^+ + Cl^- $$
E così via.
