Il metodo delle semireazioni redox
Un criterio per bilanciare una reazione redox (ossido-riduzione) si basa sui numeri di ossidazione.
- Calcolo il numero di ossidazione di ogni specie
- Identifico le specie che si ossidano (incremento n.o.) e quelle che si riducono (decremento n.o.)
- Scrivo la reazione di ossidazione e la reazione di riduzione includendo gli elettroni scambiati
- Bilancio la carica con dei ioni H+ in ambiente acido e ioni OH- in ambiente basico
- Bilancio la massa tramite l'aggiunta di molecole d'acqua
- Bilancio il numero degli elettroni scambiati nelle reazioni di ossidazione e di riduzione
- Sommo le reazioni di ossidazione e reazione, eliminando i termini simili.
Un esempio semplice
Questa reazione è di ossido-riduzione perché il ferro (Fe) riduce il proprio n.o. nel prodotto mentre il rame (Cu) lo aumenta.
$$ Cu + Fe^{3+} \rightarrow Cu^{2+} + Fe^{2+} $$
Quindi, il ferro si ossida e il rame si riduce.
Scrivo separatamente le semireazioni di ossidazione e di riduzione.
$$ Cu \rightarrow Cu^{2+} $$
$$ Fe^{3+} \rightarrow Fe^{2+} $$
In questo caso le masse sono bilanciate.
Nota. Nella reazione di riduzione il rame ha un atomo tra i reagenti e un atomo nel prodotto. Lo stesso accade nella reazione di ossidazione per il ferro.
Il numero di elettroni però non è bilanciato perché il rame perde due elettroni nella reazione di riduzione (RED).
Il ferro, invece, acquista un elettrone nella reazione di ossidazione (OX).
$$ Cu \rightarrow Cu^{2+} + 2e^- $$
$$ Fe^{3+} + e^- \rightarrow Fe^{2+} $$
La reazione OX e RED hanno un numero diverso di elettroni scambiati.
La reazione OX ha 2 elettroni scambiati mentre la reazione RED ne ha uno solo.
Quindi, per bilanciare gli elettroni scambiati moltiplico per due la reazione RED.
$$ Cu \rightarrow Cu^{2+} + 2e^- $$
$$ 2 (Fe^{3+} + e^-) \rightarrow 2Fe^{2+} $$
Poi sommo membro a membro le due semireazioni
$$ Cu + 2 (Fe^{3+} + e^-) \rightarrow Cu^{2+} + 2e^- + 2Fe^{2+} $$
Svolgo i calcoli algebrici ed elimino i termini uguali presenti a destra e a sinistra
$$ Cu + 2 Fe^{3+} + 2e^- \rightarrow Cu^{2+} + 2e^- + 2Fe^{2+} $$
$$ Cu + 2 Fe^{3+} \rightarrow Cu^{2+} + 2Fe^{2+} $$
Il risultato finale è la reazione redox bilanciata.
La verifica del bilanciamento. Per verificare se il risultato è corretto calcolo il numero di ossidazione complessivo a destra e a sinistra. L'atomo di rame (Cu) ha n.o.=0 (perché è un atomo isolato) mentre il ferro ha n.o.=+3. Quindi a sinistra il n.o. complessivo è +6. A destra lo ione di rame ha n.o.=2+ mentre lo ione di ferro ha numero di ossidazione n.o.=+2. Quindi, considerando che ci sono due atomi di ferro, a destra il n.o. complessivo è +6. Il n.o. del membro di sinistra eguaglia il membro di destra. Quindi, la reazione redox è corretta.
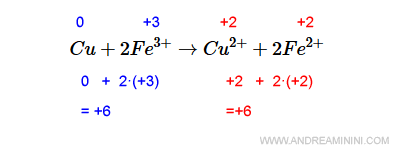
Un esempio complesso
Prendo in considerazione questa reazione chimica
$$ KCl + HNO_3 + O_2 \rightarrow KNO_3 + Cl_2 + H_2O $$
Si tratta di una reazione di ossido-riduzione (redox) perché alcuni numeri di ossidazione degli elementi chimici nelle sostanze reagenti cambiano nel prodotto.
Esempio. A sinistra il cloro ha numero di ossidazione -1 in quanto gli manca un elettrone per completare l'ottetto mentre a destra è zero perché due atomi di cloro sono legati tra loro in una molecola di cloro. Basta questo per capire che si tratta di una reazione redox.
Calcolo il numero di ossidazione di ogni elemento chimico.
Per cominciare assegno n.o.=0 alle molecole O2 e Cl2.
Poi, sapendo che il cloro (Cl) ha n.o.=-1 nella molecola KCl, in quanto gli manca un solo elettrone per completare l'ottetto, il potassio (K) deve avere necessariamente n.o.=+1.

Nota. Il cloro (Cl) aumenta il proprio n.o. nel prodotto, quindi il cloro si ossida.
Nei composti il n.o. dell'ossigeno è sempre -2 ad eccezione del legame con il fluoro.
Quindi, nella molecola d'acqua H2O il n.o. dell'ossigeno è -2.
Di conseguenza il n.o. dell'idrogeno (H) è -1 poiché ci sono due atomi di idrogeno.
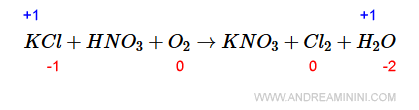
Nota. L'ossigeno (O) riduce il proprio n.o. nel prodotto, quindi l'ossigeno si riduce.
Infine, sapendo che nella specie HNO3 il n.o. dell'ossigeno è -2, mentre quello dell'idrogeno è +1, deduco che il n.o. dell'azoto (N) è +5.
Allo stesso modo, nella specie KNO3 deduco che il n.o. del potassio (K) è +1.
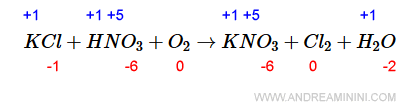
Nota. Il potassio (K) conserva il proprio numero di ossidazione +1 sia nei reagenti che nel prodotto. Quindi, non si ossida, né si riduce. Lo stesso accade per l'idrogeno che mantiene il n.o. = +1 sia a destra che a sinistra.
Pertanto, nella reazione chimica il cloro (Cl) si ossida mentre l'ossigeno (O) si riduce.
Scrivo la reazione chimica in forma ionica (dissociata) separando i sali in ioni.
$$ K^+ + Cl^- + H^+ + NO_3^- + O_2 \rightarrow K^+ +NO_3^- + Cl_2 + H_2O $$
Scrivo la reazione chimica di ossidazione considerando soltanto le specie che si ossidano.
$$ Cl^- \rightarrow Cl_2 $$
Poi scrivo la reazione chimica di riduzione considerando soltanto le specie che si riducono
$$ O_2 \rightarrow H_2 O $$
A questo punto verifico se le due reazioni hanno lo stesso numero di ossidazione.
A questo punto bilancio le due reazioni separatamente, considerando sia la massa (numero di atomi degli elementi) e sia il numero di elettroni.
- Il bilanciamento della reazione di ossidazione
Dal punto di vista della massa ci sono due atomi di cloro a destra, ma uno solo a sinistra. $$ Cl^- \rightarrow Cl_2 $$ Quindi moltiplico per due il primo membro per bilanciare la massa. $$ 2Cl^- \rightarrow Cl_2 $$ Dal punto di vista del numero di elettroni, a sinistra il n.o. è -2 mentre a destra è zero. Quindi, il cloro acquisisce due elettroni nel prodotto $$ 2Cl^- \rightarrow Cl_2 + 2e^- $$ In questo modo bilancio le cariche elettriche a sinistra e a destra. - Il bilanciamento della reazione di riduzione
Dal punto di vista della massa ci sono due atomi di ossigeno a sinistra e un atomo a destra. Inoltre, ci sono due atomi di idrogeno a destra e zero a sinistra. $$ O_2 \rightarrow H_2 O $$ Per bilanciare la massa moltiplico per due le molecole d'acqua e aggiungo quattro ioni di idrogeno H+ a sinistra. $$ O_2 + 4H^+ \rightarrow 2H_2 O $$ Dal punto di vista del numero di elettroni, a sinistra il numero di ossidazione è +4 mentre a destra è 0. Quindi aggiungo 4 elettroni e- a sinistra. $$ O_2 + 4H^+ + 4e^- \rightarrow 2H_2 O$$ In questo modo bilancio le cariche elettriche a sinistra e a destra.
Le due semireazioni bilanciate sono:
$$ 2Cl^- \rightarrow Cl_2 + 2e^- $$
$$ O_2 + 4H^+ + 4e^- \rightarrow 2H_2 O$$
A questo punto devo bilanciare gli elettroni ceduti e acquistati in entrambe le semireazioni.
Nella prima reazione il cloro acquista due elettroni mentre nella seconda gli ioni di idrogeno cedono quattro elettroni.
Per bilanciare il numero di elettroni acquisiti e ceduti devo moltiplicare per due la prima reazione.
$$ 2 ( 2Cl^- \rightarrow Cl_2 + 2e^- ) $$
$$ O_2 + 4H^+ + 4e^- \rightarrow 2H_2 O$$
E ottengo
$$ 4Cl^- \rightarrow 2Cl_2 + 4e^- $$
$$ O_2 + 4H^+ + 4e^- \rightarrow 2H_2 O$$
L'ultimo passaggio è la somma membro a membro delle due semireazioni
$$ 4Cl^- + O_2 + 4H^+ + 4e^- \rightarrow 2Cl_2 + 4e^- + 2H_2 O $$
Elimino i termini uguali a sinistra e a destra (+4e-).
$$ 4Cl^- + O_2 + 4H^+ \rightarrow 2Cl_2 + 2H_2 O $$
Alla reazione aggiungo i termini non ossidati/ridotti della reazione chimica iniziale in forma molecolare (non dissociata).
Nota. La reazione iniziale è la seguente $$ KCl + HNO_3 + O_2 \rightarrow KNO_3 + Cl_2 + H_2O $$
In quest'ultima operazione devo fare riferimento agli ultimi coefficienti stechiometrici trovati ed eventualmente bilanciare le specie se necessario.
$$ 4KCl + 4HNO_3 + O_2 \rightarrow 4KNO_3 + 2Cl_2 + 2H_2 O $$
Il risultato finale è la reazione chimica redox bilanciata
E così via.
