Come bilanciare una reazione redox
Il bilanciamento di una reazione chimica di ossido-riduzione (redox) consiste nell'eguagliare la massa, il numero di elettroni e la carica elettrica dei reagenti e del prodotto.
Una reazione chimica è detta redox se alcune specie si ossidano mentre altre si riducono nel prodotto rispetto allo stato iniziale di reagente.
Dove red sta per riduzione e ox per ossidazione,
Per bilanciare la reazione redox seguo questi passaggi:
- Determino il numero di ossidazione delle specie
- Bilancio il numero degli elettroni delle specie che si ossidano e che si riducono
- Bilancio le cariche elettriche
- Bilancio la massa
Un esempio di bilanciamento
Prendo in considerazione questa reazione chimica
$$ MnO^-_4- + Fe^{2+} \rightarrow Mn^{2+} + Fe^{3+} $$
La reazione avviene in ambiente acido ossia in soluzione acquosa.
$$ MnO^-_{4(aq)} + Fe^{2+}_{(aq)} \rightarrow Mn^{2+}_{(aq)} + Fe^{3+}_{(aq)} $$
1] Determinare il numero di ossidazione
Per prima cosa calcolo i numeri di ossidazione degli elementi per verificare se è una reazione di ossido-riduzione.
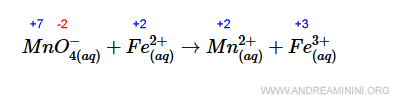
Nota. Gli atomi Fe2+, Mn2+ e Fe3+ sono ioni positivi, quindi il n.o. coincide con la carica elettrica dello ione. Nel composto MnO4-, invece, sapendo che l'ossigeno ha numero di ossidazione -2, ci sono 4 atomi di ossigeno e un elettrone viene acquisito (il simbolo - in apice), per calcolare il numero di ossidazione del manganese ricorro a una semplice equazione $$ x + 4(-2) + 1 = 0 \\ x -7 = 0 \\ x = 7 $$ Quindi, il n.o. del manganese è +7.
Il n.o. del manganese passa da +7 a +2. Quindi, si riduce.
Il n.o. del ferro, invece, passa da +2 a è +3. Quindi, si ossida.
Si tratta di una reazione di ossido-riduzione.
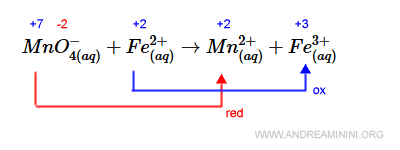
Una volta appurato che si tratta di una reazione di ossido-reazione, bilancio gli elettroni della reazione.
2] Bilanciare il numero degli elettroni
Il numero degli elettroni acquisiti dalle specie che si ossidano deve essere uguale al numero degli elettroni persi dalla specie che si riducono.
Il manganese acquista +5e- elettroni perché il suo n.o. passa da +7 a +2. Il ferro perde un elettrone -e- perché il suo n.o. passa da +2 a +3.
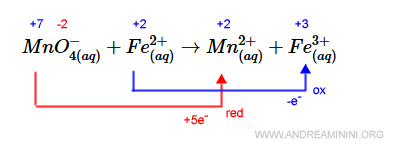
Per bilanciare il numero di elettroni acquisiti (+5) e persi (-1) nella reazione devo moltiplicare per cinque il coefficiente del ferro.
$$ MnO^-_{4(aq)} + 5Fe^{2+}_{(aq)} \rightarrow Mn^{2+}_{(aq)} + Fe^{3+}_{(aq)} $$
Per rispettare la legge di conservazione delle masse, se ci sono 5 atomi di manganese nei reagenti, devono esserci 5 atomi di manganese anche nel prodotto.
$$ MnO^-_{4(aq)} + 5Fe^{2+}_{(aq)} \rightarrow Mn^{2+}_{(aq)} + 5Fe^{3+}_{(aq)} $$
A questo punto posso analizzare il bilancio delle cariche elettriche.
3] Bilanciare le cariche elettriche
Una reazione chimica deve rispettare il principio di conservazione delle cariche elettriche.
Quindi, la somma delle cariche elettriche nei reagenti deve eguagliare quella nei prodotti. In caso contrario, devo aggiungere degli ioni H+ o OH- per bilanciare la reazione.
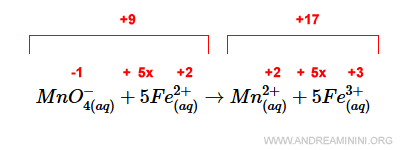
In questo caso a sinistra c'è una carica elettrica +9 mentre a destra +17.
Per bilanciare le cariche elettriche devo aggiungere 8 ioni H+ a sinistra.
In questo modo, la carica elettrica è +17 sia a destra che a sinistra.
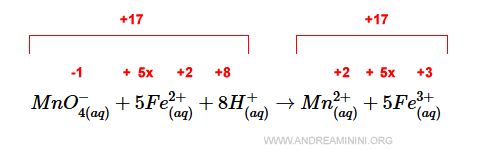
Una volta bilanciate le cariche elettriche, resta solo da bilanciare le masse.
4] Bilanciare la massa
Secondo la legge di conservazione della massa, ogni reazione chimica deve avere lo stesso numero di atomi per ogni elemento chimico sia a sinistra che destra.
$$ MnO^-_{4(aq)} + 5Fe^{2+}_{(aq)} + 8H^+_{(aq)} \rightarrow Mn^{2+}_{(aq)} + 5Fe^{3+}_{(aq)} $$
Il manganese (Mn) rispetta già la legge di conservazione perché c'è un solo atomo tra i reagenti e un solo atomo nel prodotto.
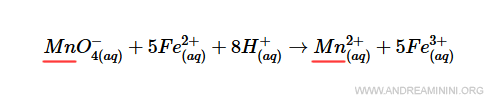
Anche il ferro (Fe) la rispetta perché ha 5 atomi nei reagenti e 5 atomi nel prodotto.
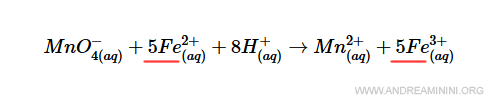
L'idrogeno, invece, non la rispetta perché ha 8 atomi nei reagenti e nessun atomi nel prodotto.
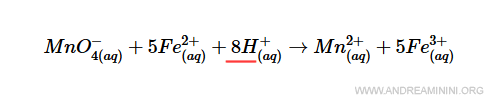
Poiché l'idrogeno quando reagisce diventa acqua, aggiungo nel prodotto 4 molecole di acqua (4H2O).
In questo modo ci sono 8 atomi di idrogeno a sinistra (8H+) e 8 atomi di idrogeno a destra (4H2).
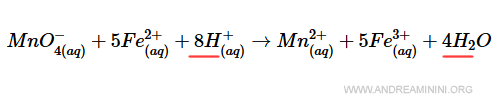
Quest'ultima modifica mi permette di bilanciare anche la massa dell'ossigeno, l'ultimo elemento che devo ancora verificare.
L'ossigeno (O) ha 4 atomi nei reagenti e 4 atomi nel prodotto.
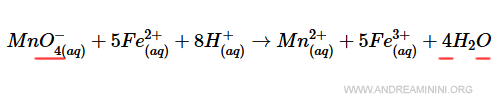
La legge di conservazione della massa è rispettata da tutti gli elementi chimici della reazione.
Ora la reazione di ossido-riduzione è bilanciata.
$$ MnO^-_{4(aq)} + 5Fe^{2+}_{(aq)} + 8H^+_{(aq)} \rightarrow Mn^{2+}_{(aq)} + 5Fe^{3+}_{(aq)} + 4H_2O $$
E così via.
