Le soluzioni
Le soluzioni sono un sistema omogeneo (monofase) composto da più specie chimiche in proporzioni variabili. La sostanza che si presenta nello stato di aggregazione o è presente in maggiore quantità è detta solvente, le altre sono dette soluti.
La dispersione delle specie chimiche è omogenea in ogni parte della soluzione.
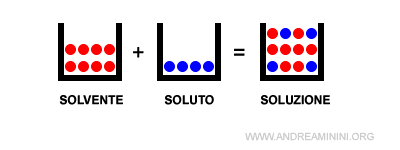
Le proprietà chimiche della soluzione variano in base al rapporto tra le quantità del solvente e dei soluti.
Il rapporto tra le sostanze può essere delimitato entro un campo di valori tra un minimo e un massimo.
Nota. In genere gli aeriformi e alcuni liquidi si sciolgono reciprocamente in tutte le proporzioni. In gran parte delle soluzioni liquide, invece, la solubilità è condizionata a proporzioni comprese entro valori minimi e massimi, al di fuori dei quali il soluto non si scioglie più nel solvente.
Quando le sostanze si trovano in fasi diverse, i soluti passano alla fase del solvente.
Esempio. Lo zucchero (solido) nell'acqua passa alla fase liquida. Lo stesso accade nell'anidride carbonica CO2 (aeriforme) che, una volta a contatto con l'acqua, passa dalla fase aeriforme alla fase liquida.
La differenza tra solvente e soluto
In una soluzione il solvente è la sostanza che scioglie le altre.
Il solvente può essere allo stato solido, liquido o aeriforme.
Generalmente, il solvente è presente in quantità maggiore rispetto alle altre sostanze presenti nella soluzione.

Il soluto è, invece, la sostanza che viene sciolta dal solvente. E' anche detta solubile.
Anche il soluto può presentarsi allo stato solido, liquido o aeriforme.
In una soluzione possono esserci più soluti. In genere i soluti sono in quantità minori rispetto al solvente.
Esempio. L'acqua è un solvente comune. Il sale e lo zucchero sono soluti perché, se presenti entro determinate proporzioni, si sciolgono nell'acqua.
Tipi di soluzioni
Esistono tre tipologie di soluzioni
- Soluzioni gassose
Le soluzioni gassose sono composte da due o più gas o vapori diffusi l'uno nell'altro. Le miscele gassose sono caratterizzate da un'elevata miscibilità.
Esempio. L'aria è una soluzione composta da da diversi gas.
- Soluzioni liquide
In una soluzione liquida sono presenti liquidi, gas e solidi disciolti in un solvente allo stato liquido (es. acqua). Le soluzioni liquide sono le più diffuse. In particolar modo le soluzioni liquido-liquido e solido-liquido.
Esempio. Il biossido di carbonio (CO2) è un gas che si scioglie nell'acqua formando una soluzione presente nelle bevande gassate (soluzione gas-liquido). Il glucosio è un solido che si scioglie nell'acqua (soluzione solido-liquido) presente nell'acqua zuccherata. L'etanolo è una miscela liquida che si scioglie nell'acqua (soluzione liquido-liquido).
- Soluzioni solide
In una soluzione solida sono presenti liquidi, gas e solidi sciolti in un solido. Si ottengono con il raffreddamento di miscele fuse.
Esempio. L'idrogeno H2 è un gas che può essere sciolto in un solido come il palladio (soluzione gas-solido). Il mercurio Hg è un liquido che può essere sciolto nel cadmio (soluzione liquido-solido). L'oro (Au) è un solido che può essere sciolto nell'argento (Ag). Altri esempi di soluzioni solido-solido sono le leghe metalliche.
Le soluzioni vere e false
In base alle dimensioni delle particelle una soluzione può essere definita vera o falsa
- Soluzione vera
La soluzione vera è composta da particelle di piccole dimensioni (atomi o ioni) al di sotto di 1 nm. - Soluzione falsa
La soluzione falsa è composta da particelle di dimensioni superiori a 1 nm. E' anche detta dispersione colloidale.
Le soluzioni sature, sovrasature e insature
Per capire la differenza tra le soluzioni sature e insature, bisogna partire dalla definizione di solubilità
La solubilità di una sostanza è la quantità massima (grammi o moli) di un soluto che si scioglie in un'unità di volume (es. 100 grammi) di un'altra sostanza solvente a una determinata temperatura.
Dal punto di vista della solubilità una soluzione può presentarsi in tre modi diversi
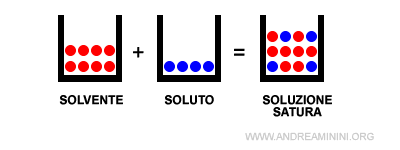
- Soluzione satura
La soluzione con la quantità massima del soluto che si scioglie in un solvente a una specifica temperatura è detta soluzione satura.
- Soluzione sovrasatura
Quando il soluto è presente in quantità superiori rispetto alla soluzione satura, il soluto cessa di sciogliersi nel solvente. In questo caso la soluzione è instabile ed è detta soluzione sovrasatura. Col passare del tempo una parte della soluzione sovrasatura tende a diventare eterogenea. Ad esempio, il soluto in eccesso si separa dalla soluzione formando dei cristalli (corpo di fondo).
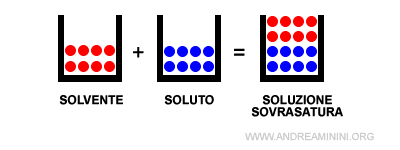
Equilibrio dinamico. In una soluzione sovrasatura si instaura un equilibrio dinamico perché la quantità di particelle del soluto che si trasferiscono dal corpo di fondo alla soluzione è uguale alla quantità di particelle della soluzione che si depositano nel corpo di fondo.
- Soluzione insatura
Se il soluto è presente in quantità inferiori alla sua solubilità in un solvente, a una particolare temperatura, la soluzione è detta soluzione insatura.
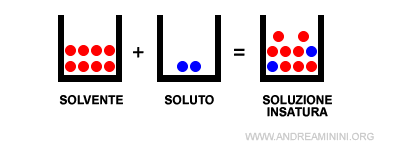
- Entro il limite di saturazione la soluzione insatura è anche detta
- soluzione diluita
se la quantità del soluto è molto inferiore rispetto alla quantità di saturazione - soluzione concentrata
se la quantità del soluto è di poco inferiore alla quantità di saturazione
- soluzione diluita
Le caratteristiche delle soluzioni
Ecco le principali caratteristiche di una soluzione
- La dispersione delle specie chimica è omogenea in ogni parte della soluzione. In genere, le particelle della soluzione hanno dimensioni di pochi nanometri.
- Una soluzione è sempre composta da una sostanza solvente e una o più soluti.
- Il rapporto tra le specie chimiche è delimitato da un campo di valori entro un minimo e un massimo. Fanno eccezione le soluzioni gassose e alcune soluzioni liquide nelle quali non ci sono limiti alle proporzioni tra le sostanze.
- Variando il rapporto tra le quantità del solvente e dei soluti, le proprietà della soluzione variano in modo continuo.
- La relazione tra la solubilità e la pressione è trascurabile nei solidi e nei liquidi, mentre nei gas è direttamente proporzionale alla pressione parziale che esercita sulla soluzione (legge di Henry).
- La relazione tra la solubilità e la temperatura è diretta se la formazione della soluzione è un processo endotermico, è inversa se è un processo esotermico. E' una regola empirica molto diffusa ma con diverse eccezioni.
E così via.
