Legge di Raoult
A parità di temperatura la pressione di vapore P di una soluzione ideale è uguale alla tensione di vapore del solvente p*A e del soluto p*B come sostanza pura per la rispettiva frazione molare. $$ P = p*_Ax_A + p*_Bx_B $$
Dove p*A e p*B sono le pressioni del solvente e del soluto come liquidi puri a una stessa temperatura.
I parametri xA e xB sono, invece, le rispettive frazioni molari del solvente e del soluto all'interno della soluzione
$$ x_A + x_B = 1 $$
Nel caso dei soluti solidi la legge di Raoult può essere semplificata in
$$ P = p*_Ax_A $$
perché nei soluti solidi la tensione vapore pB è trascurabile rispetto alla tensione vapore pB.
Nota. Se nella soluzione partecipano più soluti, basta modificare l'equazione di Raoult aggiungendo altri termini. La legge è comunque valida. $$ P = p*_Ax_A + p*_Bx_B + ... + p*_ix_i $$
Va sottolineato che la legge di Raoult si applica soltanto alle soluzioni ideali, ossia a quelle soluzioni che hanno una variazione dell'entalpia di soluzione nulla (ΔHs=0)
La spiegazione
La pressione di una soluzione è dovuta alla pressione del solvente e alla pressione del soluto.
$$ P_{tot} = P_A + P_B $$
Dove PA e PB sono le pressioni parziali del solvente e del soluto.
Secondo la legge di Raoult la pressione parziale del solvente, è uguale alla pressione del vapore del liquido puro P*A alla stessa temperatura T, moltiplicata per la frazione molare XA nella soluzione.
$$ P_A = p*_A x_A $$
Nota. La pressione p*A è la pressione del solvente come sostanza pura, ossia quando non è a contatto con il soluto.
Lo stesso vale per il soluto
$$ P_B = p*_B x_B $$
Quindi la pressione totale è uguale alla somma delle pressioni di vapore delle sostanze pure per la relativa frazione molare nella soluzione.
$$ P_{tot} = P_A + P_B $$
$$ P_{tot} = p*_A x_A + p*_B x_B $$
La legge di Raoult è confermata in modo sperimentale.
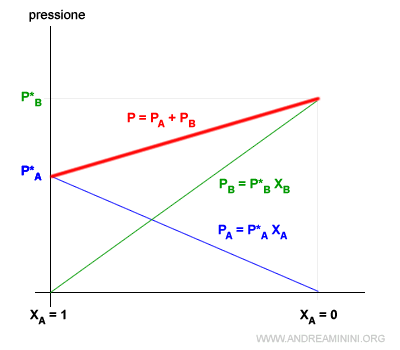
Nota. Questa rappresentazione si intende a temperatura costante.
Da questi esperimenti è emerso anche un'importante proprietà colligativa delle soluzioni ideali.
Quando in una soluzione aumenta la concentrazione del soluto XB, si riduce la frazione del solvente XA e di conseguenza si abbassa la tensione di vapore del solvente PA.
Questo fenomeno è conosciuto come abbassamento della tensione di vapore del solvente.
Una rappresentazione alternativa
La legge di Raoult può essere anche rappresentata in base all'andamento della temperatura.
Nel diagramma si misurano le temperature di inizio ebollizione (rossa) e di inizio condensazione (blu) della soluzione formata da due componenti A+B.
Sulle ascisse è misurata la frazione molare, ossia la composizione della soluzione.
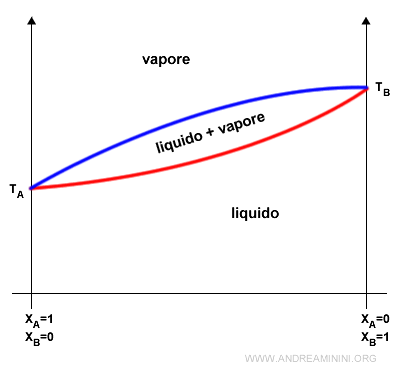
Il grafico mostra le tre situazioni di fase (liquida, liquida+vapore, vapore) della soluzione.
I punti sulle curve rappresentano gli equilibri dinamici della fase liquida (rossa) e della fase vapore (blu).
- In XA=1 la soluzione è composta soltanto dal componente A puro. Quindi TA è la temperatura di ebollizione del componente A.
- In XB=1 la soluzione è composta soltanto dal componente B puro. Quindi TB è la temperatura di ebollizione del componente B.
Nota. In questo caso è il grafico è a pressione costante. Ad esempio P=1,0 atm
Ad esempio, una soluzione con una composizione XA1 ha la temperatura di inizio ebollizione a T1.
Quando la soluzione raggiunge l'equilibrio dinamico in fase vapore la sua composizione è XA2 . Quindi, è più ricca del componente più volatile.
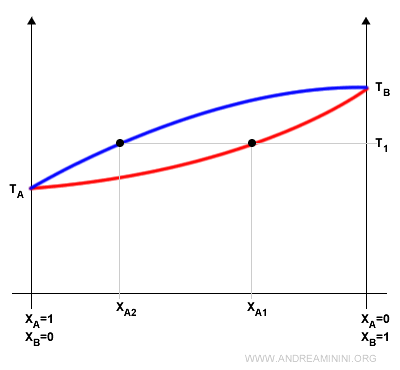
Nota. Il componente più volatile della soluzione è quello con la temperatura di ebollizione più bassa come sostanza pura. In questo caso è il componente A.
Questo processo è alla base della distillazione frazionata.
Condensando i vapori in un recipiente separato, potrei ripetere l'operazione ottenendo una miscela ancora più ricca del componente più volatile XA3.
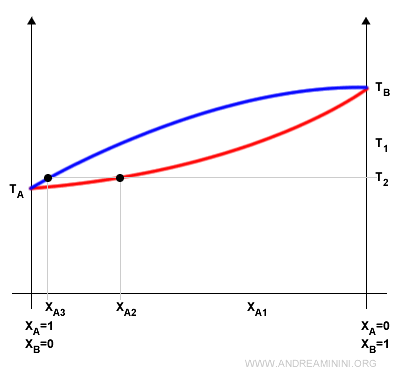
E così via.
