Interazione dipolo-dipolo
Le interazioni dipolo-dipolo sono un legame chimico debole di natura elettrostatica che si forma tra le estremità di carica opposta delle molecole polari in cui si presenti un dipolo molecolare.
Una molecola polare ha un polo di carica positiva (δ+) e l'altro di carica negativa (δ-) che generano un campo elettrico intorno alla molecola.
Quando due molecole polari si trovano abbastanza vicine tra loro, l'attrazione elettrostatica le dispone in modo ordinato, orientando i poli opposti l'uno di fronte all'altro.
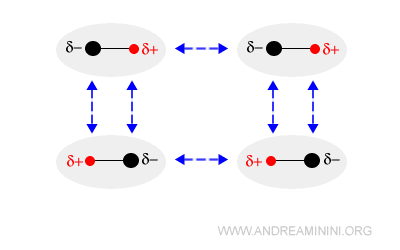
Le interazioni dipolo-dipolo sono un legame debole con energia di legame di poche decine di kJ/mol.
Nota. L'interazione dipolo-dipolo è molto più debole del legame ionico in cui due ioni sono legati tra loro con un energia pari a diverse centinaia di kJ/mol. L'interazione dipolo-dipolo è molto più debole anche del legame covalente.
Un esempio pratico
La molecola HCl è composta da un atomo di idrogeno e un atomo di cloro.
Si tratta di una molecola polare perché l'atomo di cloro è più elettronegativo dell'atomo di idrogeno.
Quindi, l'estremità della molecola in cui si trova l'atomo di idrogeno ha carica positiva (δ+), mentre quella in cui si trova l'atomo di cloro ha carica negativa (δ-).
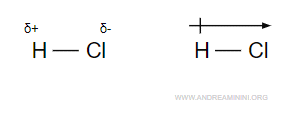
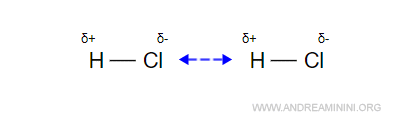
Quando due molecole HCl si trovano vicine tra loro, le reciproche attrazioni elettrostatiche le dispongono l'una verso l'estremità di carica opposta dell'altra.
Tipi di interazioni dipolo-dipolo
Esistono tre tipi di interazioni dipolo-dipolo
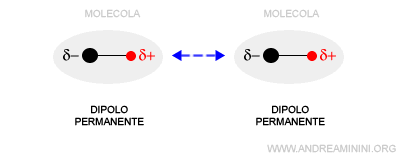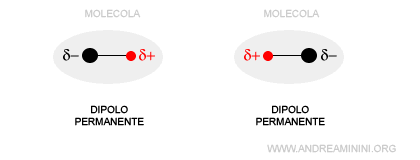
- Interazione tra dipoli permanenti
Si verifica tra due dipoli permanenti. Un dipolo è permanente quando la polarità permane nel tempo. Ad esempio, quando un atomo è più elettronegativo di un altro oppure anche a parità di elettronegatività se la forma della molecola non è simmetrica.
- Interazione tra dipolo permanente e dipolo indotto
Si verifica tra un dipolo permanente e un dipolo indotto. La forza elettrostatica attrattiva o repulsiva di un dipolo permanente influenza il moto degli elettroni delle molecole vicine (polari o apolari) trasformandole a loro volta in dipoli indotti.
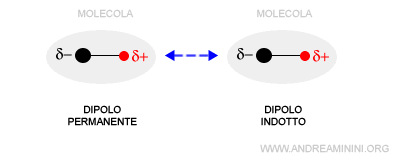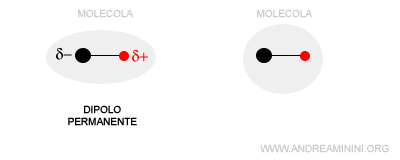
Nota. Un dipolo è detto dipolo indotto se la polarità della molecola (polare o apolare) è influenzata dalla vicinanza al dipolo permanente di un'altra molecola. Le nuvole elettroniche della molecola perturbata si deformano perché i suoi elettroni sono attratti dal polo positivo o respinti dal polo negativo del dipolo permanente. Si tratta comunque di una deformazione temporanea. Quando la molecola si allontana dal dipolo permanente, la sua distribuzione degli elettroni torna allo stato iniziale.
- Interazione tra dipolo istantaneo e dipolo indotto
Si verifica tra un dipolo istantaneo e un dipolo indotto. Anche una molecola apolare può avere un momento dipolare in alcuni brevi istanti di tempo. Questo accade a causa del moto disordinato degli elettroni che possono trovarsi temporaneamente concentrati più su un atomo che sugli altri. In questi istanti la molecola assume una polarità temporanea. Per questa ragione è detto dipolo istantaneo. A sua volta il dipolo istantaneo influenza per induzione elettrostatica la polarità nelle molecole vicine, trasformandole in dipoli indotti.
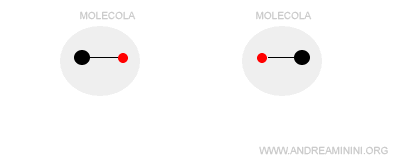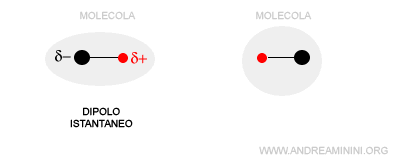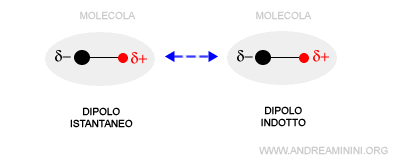
Nota. Le interazioni tra dipoli istantanei e indotti sono dette forze di van der Waals. In alcuni testi sono indicate anche come forze di London o forze di dispersione.
La polarizzabilità
La polarizzabilità è la facilità con cui una molecola si trasforma in un dipolo indotto.
La polarizzabilità aumenta con il numero degli elettroni e con il peso molecolare.
E così via.
