Teoria del legame di valenza
La teoria del legame di valenza o VB (Valence Bond) descrive la formazione delle molecole nella meccanica ondulatoria secondo la rappresentazione convenzionale in cui gli atomi condividono alcuni elettroni di valenza tramite la sovrapposizione degli orbitali atomici (uno per ogni atomo).
La teoria VB spiega la formazione del legame covalente tramite l'applicazione della meccanica quantistica.
Si basa sugli studi di Heitler, London, Slater e Pauling.
Ogni orbitale sovrapposto appartiene a un atomo diverso del legame covalente.
L'origine della teoria del legame di valenza
Negli anni '30 le equazioni di Schrodinger descrissero il comportamento degli elettroni nelle molecole.
Le equazioni sono particolarmente complesse. Pertanto, nacquero due metodi alternativi per approssimare il comportamento degli elettroni.
- La teoria della valenza (VB)
E' il metodo che più si avvicina agli studi della chimica tradizionale del primo Novecento. In particolar modo, quelli sul legame di covalenza basati sulla condivisione degli elettroni tra gli atomi. - La teoria degli orbitali molecolari
E' il metodo più innovativo che considera la molecola come un atomo, con orbitali a se stanti. E' più complessa ma anche più precisa della precedente.
L'energia di legame
Due atomi isolati posti a distanza infinita non interagiscono tra loro tramite le forze elettrostatiche.
Per semplicità considero due atomi di idrogeno perché hanno un solo elettrone nell'orbitale 1s.
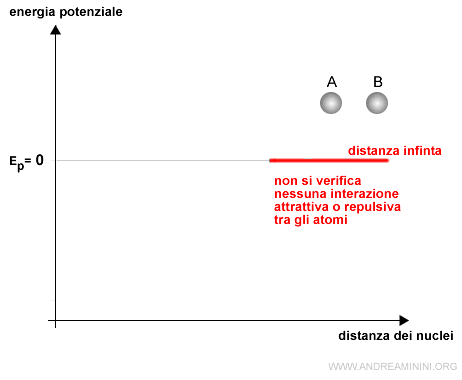
In questo caso, l'energia potenziale del sistema composto dai due atomi è considerata nulla per convenzione.
Al diminuire della distanza tra gli atomi, l'energia potenziale del sistema comincia a variare.
Bisogna distinguere tra due casi
A] Gli elettroni hanno lo stesso spin
Se gli elettroni hanno spin parallelo, l'energia potenziale aumenta all'avvicinarsi degli atomi, pertanto, gli atomi non si avvicinano.
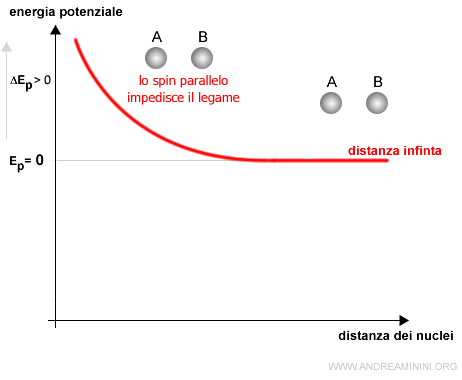
Nota. Secondo il principio di Pauling gli elettroni si dispongono prima su tutti gli orbitali con lo stesso spin. Poi occupano le posizioni con spin opposto. Quindi, se un orbitale ha due posti e uno è già occupato da un elettrone con spin UP, un altro elettrone con spin UP non può entrare nell'orbitale.
B] Gli elettroni hanno spin opposto
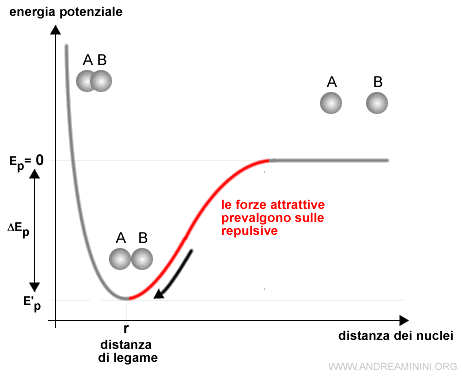
Se gli elettroni hanno spin opposto come previsto dal principio di Pauling si verificano due fenomeni
In un primo tratto le forze attrattive tra i reciproci nuclei ed elettroni prevalgono su quelle repulsive. Quindi, gli atomi si avvicinano.
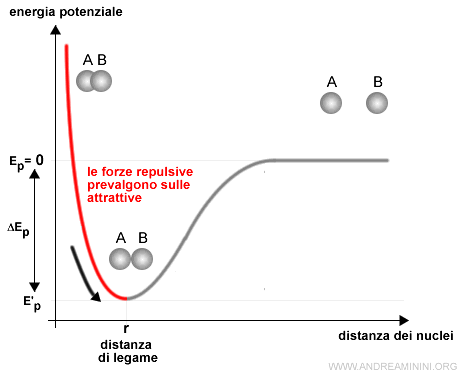
In un secondo tratto le forze repulsive tra le particelle con la stessa carica prevalgono sulle forze attrattive. Quindi, gli atomi si allontanano.
A una determinata distanza, detta lunghezza di legame, le forze repulsive e attrattive si compensano e il sistema raggiunge una situazione di equilibrio. Gli atomi mantengono la stessa distanza tra loro.
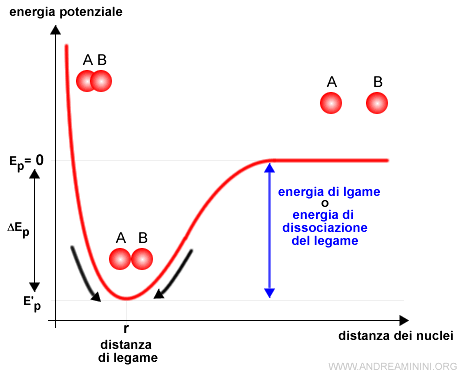
Alla lunghezza di legame l'energia potenziale del sistema raggiunge il suo valore minimo ed è detta energia di legame.
Questo accade perché in natura qualsiasi sistema tende al livello minimo di energia.
Esempio. Due atomi di idrogeno con spin opposto hanno una lunghezza di legame pari a 74 pm. L'orbitale 1s dell'atomo di idrogeno è pari a 53 pm. Quindi, la lunghezza di legame è inferiore alla distanza tra gli atomi, pari alla somma dei raggi atomici 53+53=106 pm. Ne consegue che gli orbitali 1s degli atomi sono parzialmente sovrapposti tra loro e gli elettroni possono orbitare in entrambi.
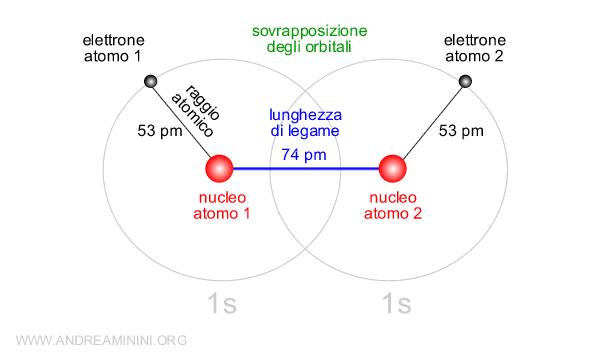
Secondo la teoria del legame di valenza, la sovrapposizione degli orbitali è la causa del legame chimico tra gli atomi.
Un esempio pratico
La molecola di cloro Cl2 è composta da due atomi di cloro tenuti insieme tra loro con un legame covalente.
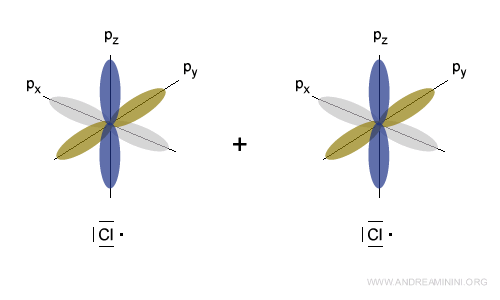
La configurazione dell'atomo di cloro è 3s2 3p5, quindi manca un elettrone negli orbitali 3p per completare l'ottetto.
La sovrapposizione di un orbitale 3p tra due atomi di cloro permette la formazione del legame covalente.
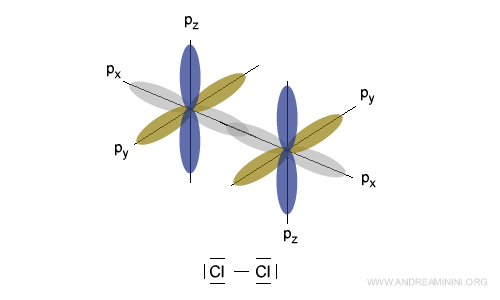
Negli orbitali sovrapposti per formare il legame la coppia di elettroni di valenza si dispone con spin opposto.
Il legame è tanto più forte, quanto più gli orbitali atomici sono sovrapposti tra loro.
Nota. La sovrapposizione degli orbitali s e px è detta legame σ (sigma) mentre la sovrapposizione degli orbitali di tipo py o pz è detta legame π (pi greco).
E così via.
