Soluzione eutettica
Una soluzione eutettica è una miscela di sostanze in cui il punto di fusione è più basso rispetto a quello delle singole sostanze pure.
Il termine eutettico deriva dal greco e significa "facile da fondere".
Una soluzione eutettica raggiunge il punto di fusione minimo in corrispondenza di una composizione X* dei componenti (frazione molare) detta composizione eutettica o punto eutettico.
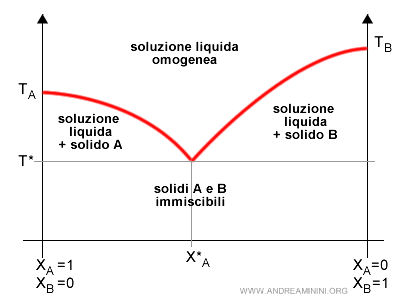
Alla composizione eutettica corrisponde una particolare temperatura T* a pressione costante, detta temperatura eutettica.
Esempio. L'acqua (H2O) e il sale (NaCl) hanno punti di fusione rispettivamente a 0°C e a 804°C. Una soluzione di acqua e sale, invece, ha un punto di fusione a -21,3°C. E' più basso rispetto alle singole sostanze pure.
Nel punto eutettico sono presenti contemporaneamente e in equilibrio sia la fase solida che la fase liquida della soluzione.
Il diagramma eutettico
I punti TA e TB sono le temperature di fusione dei componenti A e B della soluzione.
Sulle ascisse è, invece, misurata la frazione molare, ossia la percentuale dei componenti nella soluzione.
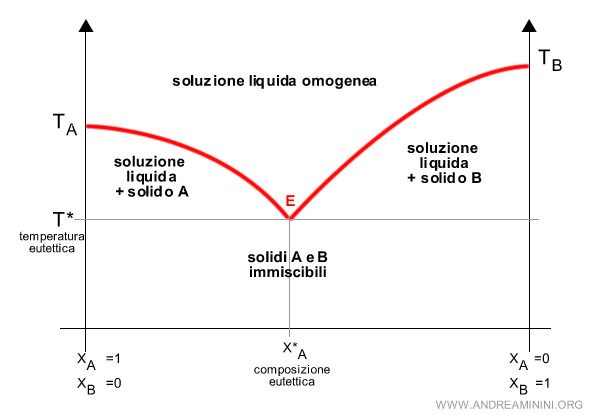
In corrispondenza della frazione XA=1 c'è soltanto il componente A allo stato puro, mentre in XA=0 c'è soltanto il componente B.
Nota. La soluzione è un sistema binario, a due componenti. Quindi, la somma delle frazioni molari dei componenti è XA+XB=1. Se XA=1, allora XB=0. E viceversa.
Al di sopra della curva i componenti sono entrambi allo stato liquido.
Al di sotto della temperatura di fusione minima, invece, i componenti sono entrambi allo stato solido.
Nel punto eutettico E la fase liquida e la fase solida sono entrambe in equilibrio.
Nota. Tra le curve di fusione e la temperatura eutettica sono anche delle situazioni in cui uno dei due componenti è allo stato solido in una soluzione liquida. Rispettivamente a sinistra e a destra del punto critico.
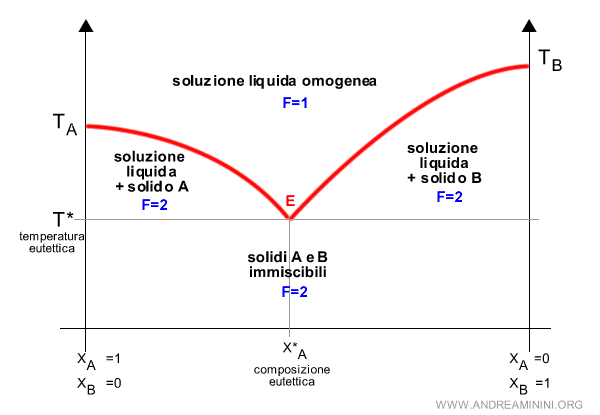
Da notare che al di sotto della curva di fusione ci sono sempre due fasi (F=2).
Al di sotto della temperatura eutettica ci sono due fasi solide perché i solidi sono immiscibili, una del componente A e l'altra del componente B.
Viceversa, al di sopra la soluzione è liquida e omogenea. In questo caso c'è una sola fase (F=1).
Il diagramma eutettico è strettamente collegato alle curve di raffreddamento dei componenti puri A e B e della soluzione A+B
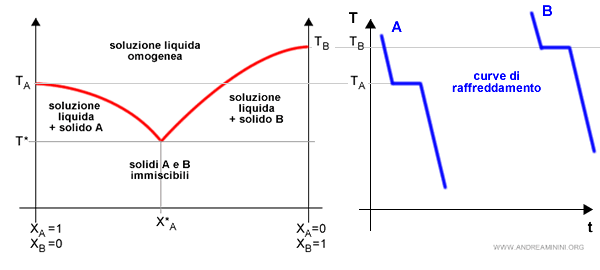
Nota. Il diagramma delle curve di raffreddamento misura la temperatura (T) sulle ordinate e il tempo (t) sull'ascisse. Poiché si presuppone che la soluzione sia riscaldata nel tempo, l'ascisse misura indirettamente anche la quantità di calore sottratto alla soluzione.
Ovviamente non c'è una sola curva di raffreddamento della soluzione A+B perché varia a seconda della composizione XA.
Nel punto eutettico X*A corrisponde alla temperatura di fusione minima ossia alla temperatura eutettica (T*).
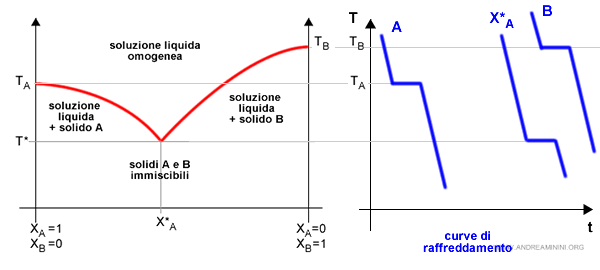
Nota. Quando si raffredda una soluzione a concentrazione eutettica X*A, la solidificazione si verifica soltanto alla temperatura eutettica. Nel momento in cui si raggiunge T* entrambi i componenti iniziano a solidificare contemporaneamente. Finché non si conclude il processo di solidificazione, la soluzione si mantiene costante alla temperatura eutettica T* (curva di raffreddamento piatta) anche se viene ulteriormente sottratto del calore. Quando il processo di solidificazione termina, tutta la soluzione è in fase solida, la curva di raffreddamento riprende a scendere.
In corrispondenza di un'altra composizione, invece, la curva di raffreddamento della soluzione è diversa.
Ad esempio, nel punto XA=0.7 la curva di raffreddamento rallenta e non diventa subito costante.
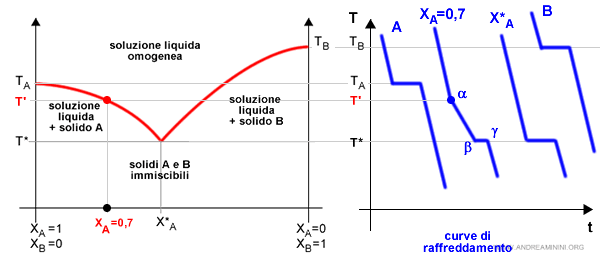
In questo caso, nel punto alfa (α) la curva di raffreddamento rallenta perché un componente inizia a solidificare.
Nel punto beta (β) la curva di raffreddamento diventa costante perché anche l'altro componente solidifica.
Nel punto gamma (γ) la curva di raffreddamento riprende a scendere perché il processo di solidificazione è terminato e tutta la soluzione è in fase solida. Quindi, l'ulteriore sottrazione di calore riduce la temperatura della soluzione.
E così via
