La distillazione frazionata
La distillazione frazionata è un processo di separazione dei componenti di una soluzione tramite evaporazione.
Si basa sulla diversa composizione (frazione molare) della soluzione in fase vapore rispetto alla fase liquida in condizioni di equilibrio liquido-vapore.
Spesso la composizione in fase vapore è più ricca del componente più volatile.
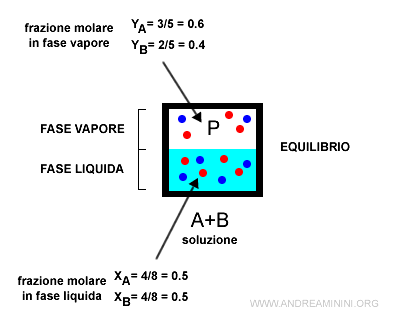
Esempio. Una soluzione è composta da A e B. La frazione molare (percentuale) dei componenti in fase liquida è xA e xB, mentre in fase vapore è yA e yB. Essendo diverse le composizioni $$ x_A \ne y_A $$ $$ x_B \ne y_B $$
Come funziona la distillazione frazionata
Una soluzione liquida è composta da un componente A (rosso) e B (giallo) .
Il componente A è più volatile del componente B. Quindi, la temperatura di ebollizione di A è più bassa.
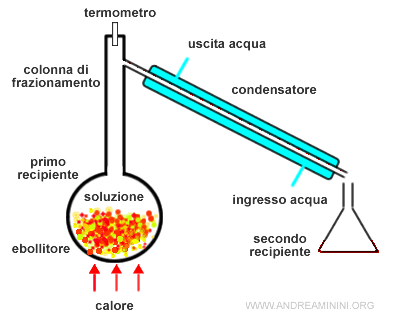
Riscaldo la soluzione liquida in un ebollitore fino alla temperatura di ebollizione del componente A in modo da far passare i suoi componenti in fase vapore.
I vapori salgono verso l'alto nella colonna di distillazione (o colonna di frazionamento).
In cima alla colonna di distillazione i vapori passano per un condensatore (raffreddato ad acqua) dove sono condensati.
Il liquido appena condensato scende per gravità in un secondo recipiente.
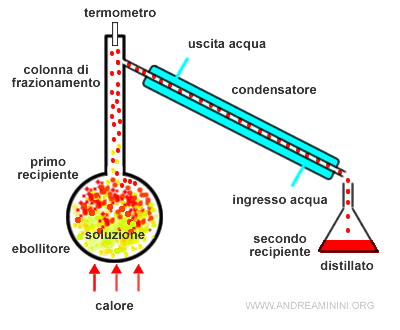
Il liquido raccolto nel secondo recipiente è più ricco della componente più volatile della soluzione, ossia del componente A (rosso).
Questo accade perché la composizione in fase vapore della soluzione è più ricca del componente più volatile rispetto alla fase liquida in equilibrio.
Il liquido residuo nel primo recipiente, invece, è più ricco della componente meno volatile della soluzione , ossia del componente B (giallo)
Ovviamente anche il componente B evapora e viene condensato nel secondo recipiente ma in percentuale minore perché è meno volatile.
Ripetendo più volte il ciclo di evaporazione-condensazione ottengo un liquido puro detto distillato, o prevalentemente puro con basse tracce dell'altro componente meno volatile.
Attenzione. In alcuni casi non è possibile separare le soluzioni in componenti puri tramite distillazione. Ad esempio, il processo di distillazione frazionata non è attuabile se una soluzione ha la stessa composizione sia in fase liquida che in fase vapore (soluzione azeotropica).
E così via.
