Reazioni chimiche redox di dismutazione
Le reazioni chimiche redox di dismutazione (o disproporzione) sono reazioni in cui uno stesso elemento chimico si ossida e si riduce.
Il termine "dismutazione" deriva dal fatto che l'elemento muta diversamente all'interno della stessa reazione.
Un esempio pratico
Prendo in considerazione questa reazione chimica in forma molecolare
$$ Cl_2 + NaOH \rightarrow NaCl + NaClO + H_2 O $$
La riscrivo in forma dissociata (ionica)
$$ Cl_2 + Na^+ + OH^- \rightarrow Na^+ +Cl^- + Na^+ + ClO^- + H_2 O $$
Scrivo i numeri di ossidazione degli elementi.
A sinistra il cloro (Cl) ha n.o. pari a zero mentre a destra assume contemporaneamente il numero di ossidazione +1 e -1.
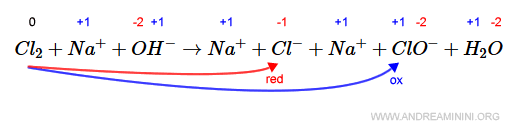
Quindi, nei prodotti il cloro si ossida (+1) e si riduce (-1).
Scrivo separatamente le due semireazioni redox della reazione chimica.
$$ Cl_2 + OH^- \rightarrow ClO^- +H_2O $$
$$ Cl_2 \rightarrow Cl^-$$
Bilancio la massa delle semireazioni
$$ Cl_2 + 4OH^- \rightarrow 2ClO^- +2H_2O $$
$$ Cl_2 \rightarrow 2Cl^-$$
Poi bilancio le cariche elettriche.
$$ Cl_2 + 4OH^- \rightarrow 2ClO^- + 2e^- +2H_2O $$
$$ Cl_2 + 2e^- \rightarrow 2Cl^-$$
Quindi sommo membro a membro le due semireazioni
$$ (Cl_2 + 2e^-) + (Cl_2 + 4OH^-) \rightarrow (2Cl^-) + (2ClO^- + 2e^- +2H_2O) $$
$$ 2Cl_2 + 2e^- + 4OH^- \rightarrow 2Cl^- + 2ClO^- + 2e^- +2H_2O $$
$$ 2Cl_2 + 4OH^- \rightarrow 2Cl^- + 2ClO^- +2H_2O $$
Ritorno alla forma molecolare della reazione chimica aggiungendo e bilanciando gli elementi non coinvolti (Na) dall'ossidazione/riduzione.
$$ 2Cl_2 + 4NaOH \rightarrow 2NaCl + 2NaClO +2H_2O $$
Poiché tutti i coefficienti sono divisibili per due, posso ulteriormente semplificare la reazione scrivendo
$$ Cl_2 + 2NaOH \rightarrow NaCl + NaClO + H_2O $$
E così via.
