Reazione di combustione
Le reazioni di combustione sono reazioni chimiche tra una sostanza e l'ossigeno che formano composti contenenti l'ossigeno liberando calore. In genere avvengono in fase gassosa.
La combustione di composti organici, contenenti carbonio e idrogeno, produce come prodotti il diossido di carbonio (CO2) o anidride carbonica, un gas incolore e inodore, e l'acqua (H2O)
Un altro composto presente nei fumi della combustione è il monossido di carbonio (CO).
La reazione di combustione è una reazione di ossido-reazione in cui l'ossigeno (comburente) è la specie che si riduce mentre l'altra specie (combustibile) si ossida.
Esempio
Una molecola di metano CH4 e due molecole di ossigeno O2 reagiscono in una reazione di combustioni liberando calore.
$$ CH_4 + 2O_2 \rightarrow CO_2 + 2H_2O $$
Il prodotto della reazione di combustione è composto da una molecola di diossido di carbonio CO2 (anidride carbonica) e due molecole d'acqua H2O.
La combustione ossida il carbonio (C) e riduce l'ossigeno (O).
Il numero di ossidazione del carbonio aumenta da -4 a +4 mentre l'ossigeno si riduce da 0 a -2.
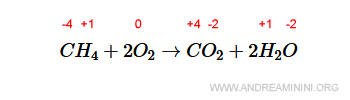
Poiché l'aria è composta dal 20% di ossigeno e 80% di azoto, la reazione di combustione completa è
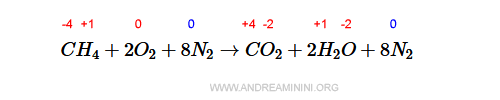
dove è subito evidente come l'azoto sia uno spettatore della reazione, poiché mantiene il suo numero di ossidazione.
E così via.
