Orbitali ibridi
Cosa sono gli orbitali ibridi
In alcuni casi gli atomi modificano i propri orbitali dallo stato fondamentale (s,p,d) a uno stato ibrido per formare più legami chimici con altri atomi.
Secondo la teoria VB i legami chimici hanno origine dagli elettroni spaiati negli orbitali atomici s, p, d, detti orbitali allo stato fondamentale sovrapposti tra loro.
Tuttavia, può anche accadere che l'atomo sposti gli elettroni negli orbitali per aumentare il numero degli elettroni spaiati o degli orbitali vuoti.
Questo processo è detto ibridazione.
Nota. Questo accade quando l'atomo riceve un'energia dall'esterno. Gli orbitali s,p,d sono particolarmente vicini. Pertanto, una minima sollecitazione può causare il salto dell'elettrone da un orbitale a un altro più esterno. In questo caso l'atomo è detto atomo eccitato. L'energia necessaria per trasformare gli orbitali dallo stato fondamentale allo stato ibrido è detta energia di promozione o energia di ibridazione.
In questo stato degli orbitali, detto stato ibrido, l'atomo può formare un numero di legami maggiore rispetto allo stato fondamentale.
Gli orbitali ibridi nascono dal rimescolamento degli orbitali fondamentali. Tuttavia, hanno una nuova forma e nuove proprietà rispetto agli orbitali fondamentali da cui sono nati.
Nota. Dal punto di vista matematico ogni orbitale è una regione dello spazio individuata da una funzione matematica. Un orbitale ibrido è la combinazione lineare delle funzioni matematiche degli orbitali allo stato fondamentale.
L'ibridazione permette all'atomo di formare più legami.
Grazie al maggior numero di legami l'atomo legato tramite gli orbitali ibridi raggiunge un livello di energia più basso dello stato fondamentale che compensa l'energia di eccitazione e di ibridazione.
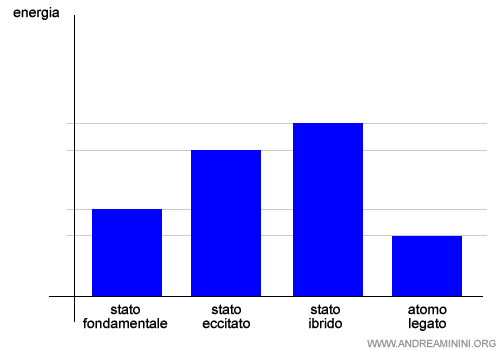
Per questa ragione i legami chimici per ibridazione sono legami stabili.
Nota. In natura tutto tende a spostarsi verso un livello di energia potenziale più basso.
La forma degli orbitali ibridi permette una maggiore sovrapposizione con gli orbitali degli altri atomi, quindi il legame chimico degli orbitali ibridi è più forte di quelli normali.
Quasi tutti i legami sigma sono composti da orbitali ibridi.
Nota. Il legame chimico di un orbitale ibrido sp è circa il doppio più forte rispetto a un legame di un orbitale s. Non è comunque necessario che ogni orbitale ibrido sia legato ad altri atomi. In una molecola può anche esserci uno o più orbitali ibridi non legati.
Un esempio pratico
La configurazione elettronica di un atomo con gli orbitali allo stato fondamentale è s2p2.
Il processo di ibridazione sposta un elettrone dall'orbitale s a un orbitale p.
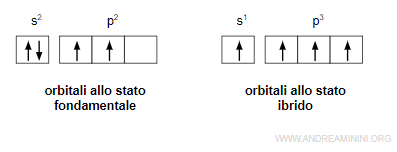
Allo stato ibrido l'atomo può formare quattro legami chimici.
Tipi di ibridazione
Esistono diversi tipi di ibridazione degli orbitali
- ibridazione sp
Si formano due orbitali ibridi equivalenti di tipo sp dal rimescolamento dell'orbitale s con un orbitale p - ibridazione sp2
Si formano tre orbitali ibridi equivalenti di tipo sp2 dalla combinazione dell'orbitale s con due orbitali p - Ibridazione sp3
Si formano 4 orbitali ibridi equivalenti di tipo sp3 dalla combinazione dell'orbitale s con tre orbitali p
Nota. Il numero degli orbitali ibridi è sempre uguale al numero degli orbitali atomici combinati mentre le forme e le geometrie dei legami chimici cambiano da caso a caso.
Altri orbitali ibridi
Gli orbitali ibridi non hanno origine soltanto dalla combinazione lineare degli orbitali s e p ma anche degli altri orbitali atomici (s, p, d) con livello di energia poco diverso.
Ecco un elenco di altre ibridazioni presenti in natura.
- sp3d
- sp3d2
- d2sp3
- sd3
- dsp2
- dsp3
E così via.
