Orbitali ibridi sp
Cos'è l'ibridazione sp
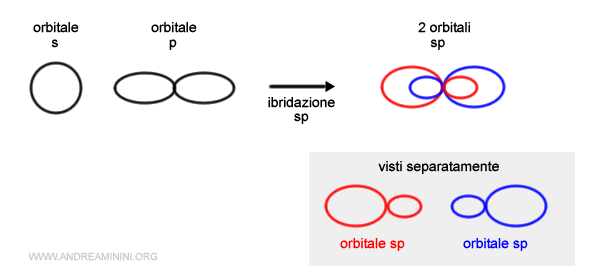
L'ibridazione sp è un processo di combinazione di un orbitale atomico di tipo s e un orbitale atomico di tipo p.
Quando l'atomo viene eccitato da un'energia esterna, detta energia di ibridazione, un elettrone si sposta dall'orbitale s all'orbitale p.
Nota. Essendo molto vicini gli orbitali s e p, non occorre una grande energia per spostare l'elettrone.
Gli orbitali s e p si trasformano in due orbitali ibridi di tipo sp disposti in direzioni opposte(180°) e uguali per forma ed energia.
Ogni orbitale sp ha due lobi, un lobo piccolo e uno grande.
Per questo motivo gli orbitali sp sono anche detti orbitali digonali.
Nota. L'ibridazione modifica anche la forma e le proprietà degli orbitali. Non si tratta di un semplice salto di elettrone da un orbitale all'altro.
Perché gli orbitali ibridi sp sono stabili?
Pur avendo un livello energetico superiore, allo stato ibrido l'atomo può formare più legami chimici che compensano il surplus di energia di ibridazione.
Quando un atomo allo stato ibrido si lega ad altri atomi raggiunge comunque un livello energetico inferiore allo stato fondamentale.
Quindi, lo stato ibrido in un atomo legato è una configurazione stabile.
Nota. In natura tutto si sposta al livello di energia potenziale più basso.
Un esempio pratico
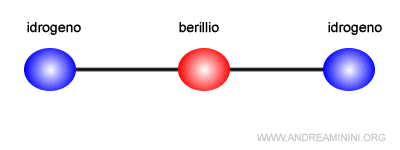
La molecola di idruro di berillio BeH2 si ottiene per ibridazione sp.
$$ BeH_2 $$
L'atomo di berillio (Be) ha una configurazione elettronica superficiale di s2, ossia ha due elettroni nell'orbitale s.
L'ibridazione sposta un elettrone dall'orbitale s all'orbitale p.
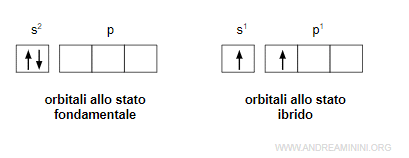
Gli orbitali s e p cambiano forma.
La combinazione lineare di un orbitale s e un orbitali p genera due orbitali ibridi sp, ognuno con un solo elettrone di valenza, orientati in direzione diametralmente opposte.
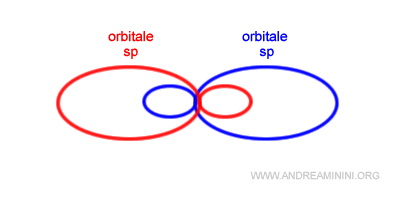
Quindi, allo stato ibrido la configurazione elettronica superficiale del berillio diventa sp1 sp1
Ogni orbitale ibrido sp si sovrappone all'orbitale s di un atomo di idrogeno (H) che ha una configurazione superficiale pari a s1.
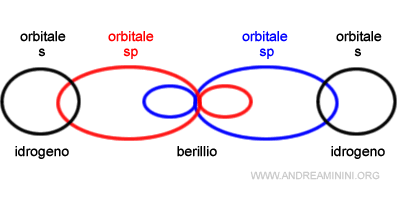
In questo modo l'atomo di berillio acquisisce due legami covalenti con due atomi di idrogeno.
Il risultato della sovrapposizione è la molecola dell'idruro di berillio BeH2.
Nota. Un processo di ibridazione sp simile si ottiene anche nella molecola di cloruro di berillio BeCl2 tra un atomo di berillio e due atomi di cloro.
E così via.
