Nomenclatura razionale
La nomenclatura razionale (o IUPAC) definisce i nomi dei composti chimici secondo un sistema standard e universale.
La nomenclatura razionale è stata presentata nel 1971 dallo IUPAC (International Union of Pure e Applied Chemistry) per sostituire la nomenclatura tradizionale dei composti chimici.
La nomenclatura IUPAC si basa principalmente sulla composizione atomica dei composti.
Suddivide i composti chimici in base al numero degli elementi chimici presenti
- binari (due elementi)
- ternari (tre elementi)
- quaternari (quattro elementi)
I nomi dei composti con più elementi riconducibili alle regole dei composti binari o ternari.
Alcune regole generali
La formula di un composto binario va scritta seguendo un determinato ordine
- Se il composto è formato da un metallo e un non metallo, si scrive prima il simbolo del metallo
Esempio. Il composto formato da litio e iodio si iscrive LiI.
- Se il composto è formato da due non metalli, si scrive prima l'elemento meno elettronegativo
Nota. A questa regola fanno eccezione i composti azoto-idrogeno e carbonio-idrogeno (es. CO2). In questi casi, il primo elemento della formula è quello più elettronegativo.
- Il nome di un composto binario senza l'ossigeno si scrive aggiungendo il suffisso -uro al non metallo
[non metallo]+uro di [metallo]
Esempio. Il composto formato da litio e iodio si iscrive LiI e si pronuncia ioduro di litio.
o all'elemento più elettronegativo che in genere (ma non sempre) sta a destra della formula.
[più elettronegativo]+uro di [meno elettronegativo]
Esempio. Il composto SiC si dice carburo di silicio perché il carbonio (C) ha elettronegatività 2.55 maggiore del silicio (Si) che 1.9.
- Il nome del composto in cui è presente l'ossigeno si dice ossido se il numero di ossidazione dell'ossigeno è -2
ossido di [altro elemento]
oppure perossido se il numero di ossidazione dell'ossigeno è -1.perossido di [altro elemento]
- Se un composto è compatibile con due o più numeri di ossidazione, si aggiunge il prefisso mono- (facoltativo), bi- oppure di-, tri-, tetra-, penta-, esa-, epta-, octa- ecc. a seconda del numero di atomi legati all'elemento.

In alternativa, si usa la notazione di Stock scrivendo il nome del composto e tra parentesi il numero di ossidazione con i numeri romani.
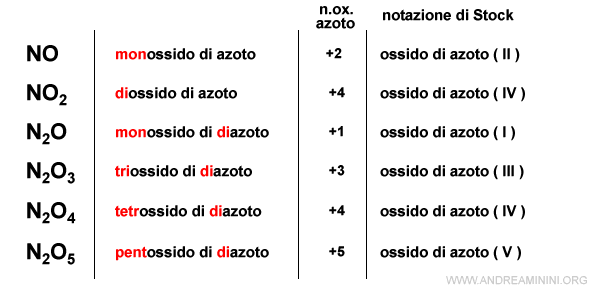
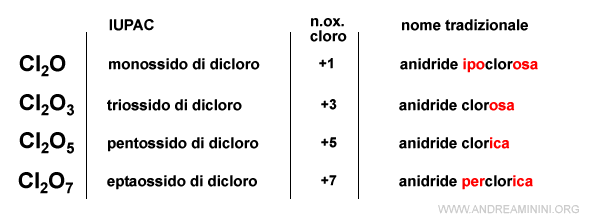
Nota. Nella nomenclatura tradizionale ai composti con l'ossigeno si aggiungeva il suffisso -oso all'elemento con numero di ossidazione più basso e il suffisso -ico a quello più alto. Si tratta comunque di una pratica comune non prevista dallo IUPAC.

Se il composto ha quattro numeri di ossidazione, si aggiunge il prefisso ipo- e il suffisso -oso a quello più basso. Si aggiunge il suffisso -oso e -ico a quelli intermedi. Si aggiunge il prefisso per- e il suffisso -ico a quello più alto.
I composti binari
I composti binari sono formati da due elementi chimici.
- Gli idruri
Sono composti binari formati dall'idrogeno (H) con un altro elemento chimico. - Gli ossidi
Sono composti binari formati dall'ossigeno (O) con un altro elemento chimico. - Gli idracidi
Sono acidi binari composti dall'idrogeno e da un elemento alogeno o dallo zolfo. - Gli ioni
Gli ioni positivi (cationi) e negativi (anioni) monoatomici e poliatomici seguono una propria nomenclatura. - I sali binari
Sono composti da un metallo e un non metallo. Sono anche detti sali di idracidi perché si ottengono dagli idracidi.
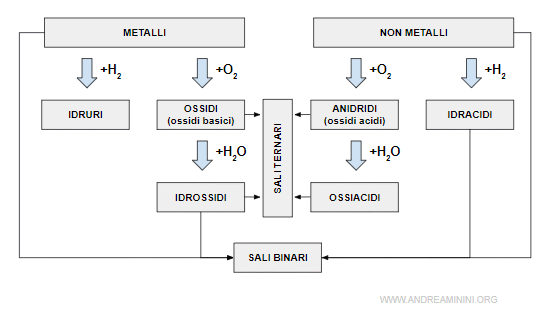
I composti ternari
- Gli idrossidi
Gli idrossidi sono un composto ternario formato da un metallo, l'ossigeno e l'idrogeno. - Gli ossiacidi
Gli ossiacidi sono un composto ternario formato da un non metallo, l'ossigeno e l'idrogeno. - I sali ternari
I sali ternari (o sali di ossiacidi) sono composti da un metallo, un non metallo e l'ossigeno.
Nota. Gli ossiacidi e gli idracidi fanno parte degli acidi ossia di quei composti che liberano uno ione H+ in una soluzione acquosa.
E così via.
