Idruri
Cosa sono gli idruri
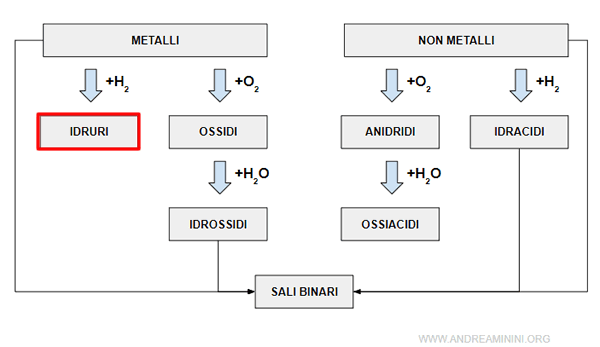
Gli idruri sono composti binari formati dall'idrogeno e da un elemento chimico.
Esistono due tipi di idruri
- Idruri metallici
Sono composti ionici formati dall'idrogeno e da un metallo. L'idrogeno ha numero di ossidazione -1. - Idruri non metallici
Sono composti covalenti formati dall'idrogeno e da un non metallo. L'idrogeno ha numero di ossidazione +1.
Nella nomenclatura IUPAC un idruro è detto
idruro di [altro elemento]
Tuttavia, secondo le regole IUPAC, si considerano idruri propriamente detti soltanto gli idruri metallici, ossia quelli in cui l'idrogeno ha n.o. pari a -1.
Quindi, per chiamare gli idruri non metallici si usa la nomenclatura dei composti binari aggiungendo il suffisso -uro sull'elemento più elettronegativo.
Un esempio pratico
Esempio 1 (idruro)
Il litio (metallo) e l'idrogeno formano l'idruro di litio
$$ Li H $$
Esempio 2 (idruro)
Il potassio (metallo) e l'idrogeno formano l'idruro di potassio
$$ K H $$
Esempio 3 (idruro)
Alcuni idruri conservano il proprio nome tradizionale.
Ad esempio, il triidruro di azoto (NH3) è detto ammoniaca.
Il triidruro di fosforo (PH3) è detto fosfina.
Esempio 4 (non idruro)
Il composto tra il bromuro (non metallo) e l'idrogeno non è detto idruro perché l'idrogeno ha n.o. pari a +1.
E' detto bromuro di idrogeno.
$$ H Br $$
In questo caso nella formula chimica l'idrogeno (H) si trova al primo posto perché è l'elemento meno elettronegativo.
Esempio 5 (non idruro)
Il composto tra lo zolfo (non metallo) e l'idrogeno non è detto diidruro di idrogeno perché l'idrogeno ha n.o. pari a +1.
E' detto solfuro di diidrogeno.
$$ H_2 S $$
La differenza tra idruri metallici e non metallici
Gli idruri metallici sono anche detti idruri salini, perché si comportano da base quando reagiscono con l'acqua.
$$ KH + H_2O \rightarrow K^+ HO^- + H_2 $$
Gli idruri non metallici, invece, si comportano da acidi quando reagiscono con l'acqua.
$$ HBr + H_2O \rightarrow Br^- + H_3O^+ $$
E così via.
