L'equilibrio chimico
Cos'è l'equilibrio chimico
L'equilibrio chimico è una condizione dinamica raggiunta da una reazione chimica incompleta e reversibile, quando la reazione diretta (reagenti->prodotti) $$ A+B \rightarrow C+D $$ e la reazione inversa (prodotti->reagenti) $$ A+B \leftarrow C+D $$ si verificano contemporaneamente con la stessa velocità di reazione. $$ A+B \leftrightharpoons C+D $$
Una reazione chimica è
- reversibile
quando può avvenire in entrambi i sensi - incompleta
se i reagenti non si trasformano completamente in prodotti
In queste circostanze può verificarsi un equilibrio chimico se la velocità di reazione è la stessa in entrambi i sensi.
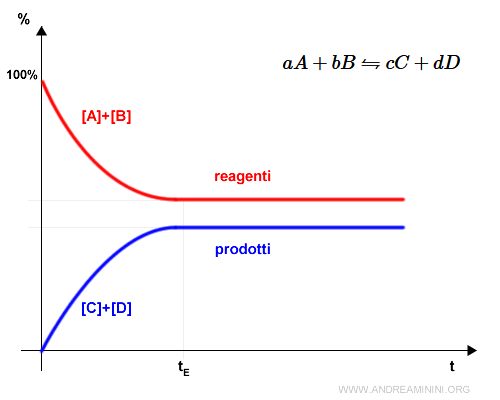
Esempio. Inizialmente il sistema è composto al 100% dai reagenti. La reazione trasforma i reagenti in prodotti facendo diminuire la composizione dei reagenti [A]+[B] e aumentare quella dei prodotti [C]+[D]. $$ A+B \rightarrow C+D $$ Tuttavia la velocità di reazione da reagenti a prodotti tende a diminuire progressivamente nel tempo. Questo accade perché anche i prodotti C e D reagiscono tra loro in una reazione inversa che aumenta le sostanze [A]+[B]. $$ A+B \leftarrow C+D $$ Quando le due velocità di reazione (diretta e inversa) si eguagliano al tempo tE, le composizioni dei reagenti e dei prodotti restano costanti. E' un esempio di equilibrio chimico.
L'equilibrio chimico è un equilibrio dinamico e non statico, perché le reazioni chimiche (diretta e inversa) continuano a verificarsi nel tempo, verso destra e verso sinistra, ma si compensano reciprocamente.
Nel sistema i prodotti e i reagenti sono contemporaneamente presenti in concentrazioni non necessariamente uguali.
Al punto che agli occhi di un osservatore esterno potrebbe sembrare terminata la reazione chimica. Ma non è così.
L'equilibrio chimico può presentarsi solo in reazioni reversibili e incomplete.
Nota. Una reazione irreversibile non potrà mai essere in equilibrio dinamico perché la reazione è completa, raggiunge un equilibrio statico quando almeno uno dei reagenti (lato sinistro) è esaurito, i prodotti sono completi (lato destro) e la reazione chimica cessa del tutto di verificarsi (es. combustione). $$ A+B \rightarrow C+D $$
Nell'istante tE le velocità di reazione diretta (reagenti>prodotti) e la velocità di reazione inversa (prodotti>reagenti)sono uguali.
$$ v_D = v_I $$
Quindi, le concentrazioni dei reagenti e dei prodotti diventano costanti.
La dimostrazione
In equilibrio chimico la composizione dei reagenti e dei prodotti non cambia.
Per dimostrarlo parto dall'uguaglianza tra la velocità di reazione diretta e inversa
$$ v_D = v_R $$
Sapendo che in cinetica chimica la velocità di reazione diretta e inversa sono
$$ v_D=k_D[R] $$
$$ v_I=k_P[P] $$
Dove tra parentesi quadre [ ] indico la composizione dei reagenti R e dei prodotti P moltiplicate per le rispettive costanti k di velocità.
Quindi, posso riscrivere l'uguaglianza tra le velocità di reazione diretta e inversa in questo modo
$$ v_D = v_I $$
$$ k_D[R] = k_P[P] $$
E con un semplice passaggio algebrico metto in evidenza le costanti nel membro di sinistra
$$ \frac{k_D}{k_P} = \frac{[P]}{[R]} $$
Poiché kD e kP sono costanti, anche il rapporto tra le composizioni dei prodotti e dei reagenti [P]/[R] è costante.
Pertanto, se le velocità di reazione diretta e inversa sono uguali, le composizioni dei reagenti e dei prodotti sono costanti.
Inoltre, poiché la velocità diretta e inversa non sono nulle, entrambe le reazioni continuano ad avvenire nel tempo anche in equilibrio chimico.
La costante di equilibrio
La costante di equilibrio è il rapporto tra il prodotto delle composizioni dei prodotti elevate per i relativi coefficienti stechiometrici e quello dei reagenti in condizioni di equilibrio chimico. $$ K=\frac{[C]^c \cdot [D]^d}{[A]^a \cdot [B]^b} $$
Dove [A] e [B] sono le concentrazioni (frazioni molari) dei reagenti mentre [C] e [D] sono le concentrazioni dei prodotti di una generica reazione chimica.
$$ aA + bB \leftrightharpoons cC + dD $$
Gli esponenti a,b,c,d sono i coefficienti stechiometrici delle specie chimiche nei reagenti e nei prodotti.
E' anche nota come legge di azione di massa.
$$ K_c=\frac{[C]^c \cdot [D]^d}{[A]^a \cdot [B]^b} $$
Nota. E' indicata con Kc, dove c significa concentrazioni, per distinguerla da una formula equivalente calcolata in base alle pressioni.
Se le specie sono in fase aeriforme, la costante di equilibrio posso anche scriverla usando le pressioni parziali delle specie.
$$ K_p = \frac{(p_A)^a \cdot (p_B)^b}{(p_C)^c \cdot (p_D)^d} $$
Dove p sono le pressioni parziali di ogni singola specie elevate ai relativi coefficienti.
Le costanti di equilibrio Kc e Kp sono equivalenti tra loro.
Termodinamica dell'equilibrio chimico
In termodinamica un processo è in equilibrio se la variazione di energia libera di Gibbs è nulla.
$$ \Delta G = H - TS = 0 $$
Dove H è l'entalpia, T è la temperatura e S è l'entropia.
A parità di temperatura, la condizione ΔG=0 si verifica a un particolare stato di avanzamento della reazione chimica, quando la quantità relativa delle sostanze diventa costante.
Inizialmente l'energia libera G del sistema diminuisce al variare della composizione, seguendo un andamento a U.
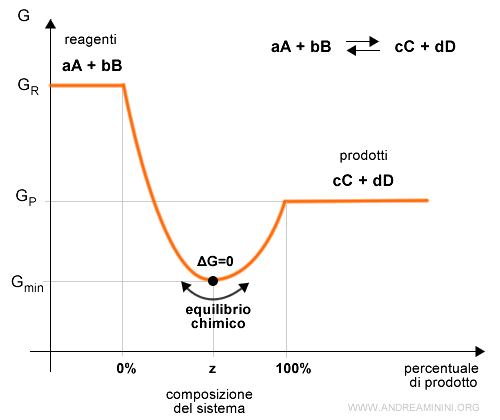
Il sistema raggiunge spontaneamente il minimo di energia libera quando la variazione di energia libera è nulla ossia ΔG=0.
In corrispondenza del minimo di energia libera si ottiene una particolare composizione (z) dei reagenti e dei prodotti.
Questo punto è detto equilibrio chimico dinamico.
La legge di van't Hoff
La legge di vant'Hoff mi permette di calcolare la variazione di entalpia standard (ΔH°) se conosco le costanti di equilibrio (K*1,K*2) calcolate a due temperature diverse (T1,T2). $$ \log \frac{ K_1* } {K_2* } = \frac{\Delta H°}{R} \cdot ( \frac{ 1}{T_2} - \frac{1 }{T_1} ) $$
Da questa legge si comprende che soltanto la temperatura produce una variazione della costante di equilibrio K*.
La costante di equilibrio non va comunque confusa con l'equilibrio chimico che, invece, dipende da molti altri fattori.
Fattori che influenzano l'equilibrio chimici
A parità di costante di equilibrio K e di temperatura, l'equilibrio chimico di una reazione può cambiare al variare dei seguenti fattori
- volume
- pressione
- aggiunta o sottrazione di componenti
La variazione del volume
Esempio 1
Data una reazione
$$ aA \leftrightharpoons cC + dD $$
Se aumento il volume del recipiente dove si verifica la reazione chimica, secondo il principio dell'equilibrio mobile la reazione si sposta sui prodotti.
Perché?
Per compensare l'aumento del volume (sollecitazione esterna), il sistema reagisce aumentando i prodotti perché sono due moli (cC+dD), rispetto a una mole del reagente (aA).
Esempio 2
Se la reazione chimica fosse stata caratterizzata da due moli di reagenti e una di prodotto
$$ aA + bB \leftrightharpoons cC $$
Il sistema si sarebbe spostato verso i reagenti per compensare l'aumento di volume.
Nota. Se il numero delle moli dei reagenti e dei prodotti fosse uguale, non potrei affermare nulla sulle variazioni dell'equilibrio chimico tramite il principio dell'equilibrio mobile.
La variazione della pressione
Anche una variazione di pressione a temperatura costante modifica l'equilibrio chimico.
Esempio
In una generica reazione
$$ aA \leftrightharpoons cC + dD $$
l'aumento della pressione sposta l'equilibrio chimico verso i reagenti perché hanno un minor numero di moli (una mole) rispetto ai prodotti (due moli).
Nota. L'effetto di una variazione di pressione è inversamente proporzionale a una variazione del volume. Ad esempio, se la pressione aumenta, l'effetto che si produce è lo stesso di una riduzione di volume. E viceversa.
La variazione della quantità dei componenti
Una variazione della quantità dei reagenti sposta l'equilibrio chimico verso i prodotti. E viceversa.
Questo fenomeno si spiega sia con il principio di equilibrio mobile o, in alternativa, con la costante di equilibrio.
Esempio
In una generica reazione
$$ aA \leftrightharpoons cC + dD $$
Se aumento la quantità dei prodotti [C] o [D], l'equilibrio si sposta verso il reagente [A] per compensare la sollecitazione esterna.
La costante di equilibrio Kc delle concentrazioni è un valore costante.
$$ K_c = \frac{[C+\Delta C]+[D]}{[A]} $$
Quindi, a parità di costante Kc l'aumento della concentrazione del prodotto [C] genera due effetti
- La concentrazione dell'altro prodotto [D] si riduce
- La concentrazione del reagente [A] aumenta
Nota. L'aumento della quantità di un catalizzatore non produce effetti sull'equilibrio chimico perché aumenta sia la velocità di reazione diretta che inversa.
Le variazioni di temperatura e l'equilibrio chimico
Secondo la legge di van't Hoff una variazione di temperatura modifica la costante di equilibrio di una reazione chimica.
L'effetto di una variazione di temperatura sulla costante di equilibrio Kc dipende dalla variazione di entalpia (ΔH) della reazione chimica.
- Reazione esotermica (ΔH<0)
In una reazione esotermica l'aumento della temperatura sposta l'equilibrio verso i reagenti. Viceversa, una diminuzione di temperatura verso i prodotti.Esempio. Se aumenta la temperatura in una generica reazione esotermica (ΔH<0) rilascia calore Q dal lato dei prodotti. $$ A + B \leftrightharpoons C + Q $$
In base al principio di equilibrio mobile il sistema si oppone all'incremento di temperatura assorbendo il calore prodotto Q quella dei reagenti A e B. In pratica, la reazione tende ad assorbire il calore prodotto Q favorendo così la formazione dei reagenti (A e B). - Reazione endotermica (ΔH>0)
In una reazione endotermica l'aumento della temperatura sposta l'equilibrio verso i prodotti. Viceversa, una diminuzione di temperatura verso i reagenti.Esempio. Se aumenta la temperatura in una generica reazione endotermica (ΔH>0) assorbe calore Q dal lato dei reagenti. $$ A + Q \leftrightharpoons C + D $$ In base al principio di equilibrio mobile il sistema si oppone all'incremento di temperatura assorbendo il calore (Q), favorendo così la formazione dei prodotti (F e G).
E così via.
