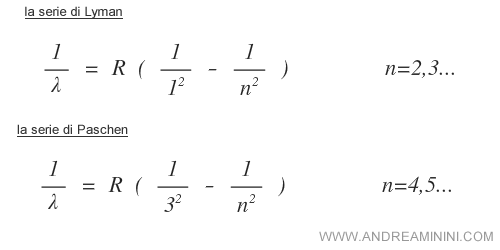Lo spettro atomico
Lo spettro atomico è la diffrazione generata dalla scomposizione della luce emessa da una sostanza elementare, quando attraversa un prisma di vetro.
Lo spettro atomico consiste in una serie di righe. L'analisi dello spettro è una tecnica utilizzata per riconoscere la tipologia degli atomi in una sostanza.

Ogni elemento chimico ha uno spettro di emissione caratteristico. Ad esempio, l'immagine precedente mostra lo spettro di emissione del ferro.
Come analizzare lo spettro
Si riscalda una sostanza elementare ( es. idrogeno ) in un tubo fino a portarla allo stato gassoso ( es. idrogeno gassoso ). Sotto forma di gas, gli atomi non sono più vincolati da una struttura rigida e si muovono liberamente nello spazio.
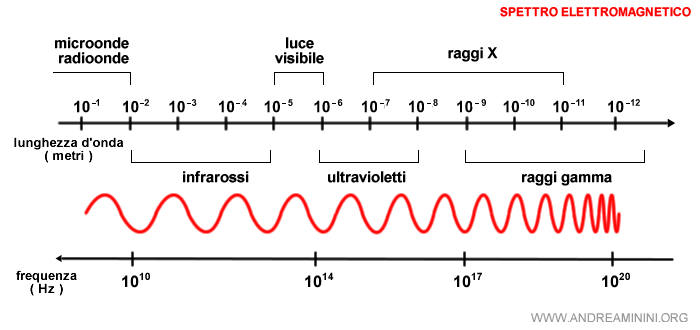
Nel tubo di vetro sono collocati due elettrodi per creare una differenza di potenziale che accelera il movimento degli elettroni ed eccita gli atomi, facendogli rilasciare una radiazione elettromagnetica ( luce ).
La luce emessa dalla sostanza gassosa ( es. idrogeno gassoso ) viene fatta passare in un prisma per trasformare il fascio di luce in uno spettro a righe.
La formula di Balmer
Il fisico svizzero J.J. Balmer fu il primo a individuare uno schema nelle righe dello spettro elettromagnetico visibile dell'atomo. In particolar modo, Balmer concentrò il proprio studio sull'atomo di idrogeno.
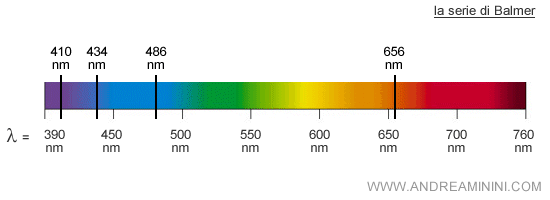
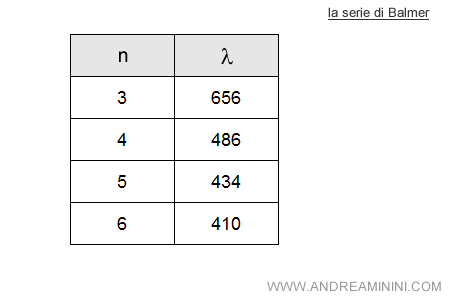
Si accorse che gli atomi di idrogeno presentavano delle righe caratteristiche in quattro particolari lunghezze d'onda: 656 nm, 486 nm, 434 nm, 410 nm.
Questa sequenza numerica è detta serie di Balmer.
Balmer ruscì a trovare una legge empirica che lega tra loro la successione delle righe caratteristiche dello spettro dell'idrogeno. Questa legge è conosciuta come formula di Balmer ed è la seguente:
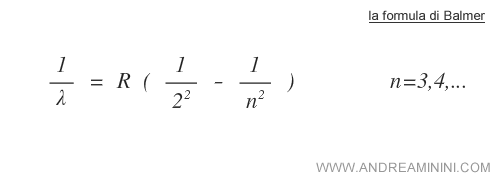
In effetti, sostituendo alla variabile n la successione ( n=3,4,5,6 ) si ottiene esattamente la successione delle lunghezze d'onda caratteristiche dello spettro dell'idrogeno.
Quindi, grazie alla formula di Balmer si possono calcolare le lunghezze d'onda delle righe dello spettro dell'atomo di idrogeno.
Costante di Rydberg. La costante R nella formula di Balmer indica la costante di Rydberg. Si tratta di una costante numerica con valori interi positivi maggiori di due, pari a R = 1097x107m-1
Nella serie di Balmer le lunghezze d'onda maggiori ( o frequenze minori ) sono associate ai numeri interi ( n ) più bassi. Ad esempio, se n=3 allora λ=656.
Successivamente ci si accorse che la formula di Balmer funzionava anche nelle lunghezze d'onda più alte, quelle al di fuori dello spettro elettromagnetico visibile.
Ad esempio, nelle lunghezze d'onda ultraviolette la serie di Balmer continua con valori n>6.
Man mano che si aumenta il valore numerico (n) e ci si sposta sulle lunghezze d'onda maggiori, le righe caratteristiche tendono ad avvinarsi tra loro sempre di più. Fino a diventare troppo vicine tra loro per essere distinguibili.
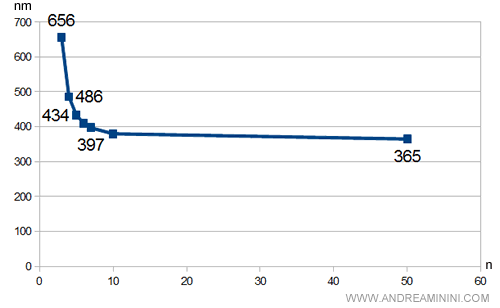
Facendo tendere la variabile n a infinito, le lunghezze d'onda dell'atomo dell'idrogeno convergono in un limite ben definito, pari a 365 nm.
Nota. Nello spettro non visibile della luce ci sono altre formule e serie più precise. In particolar modo, la serie di Lyman nell'ultravioletto e la serie di Pachen nell'infrarosso.