I numeri quantici dell'atomo
I numeri quantici definiscono le caratteristiche dei livelli energetici e degli orbitali di un atomo quantistico. Dai numeri quantici deriva la configurazione elettronica di un elemento chimico.
Il numero quantico principale
Il numero quantico principale ( n ) indica la dimensione dell'orbitale intorno al nucleo. Può assumere soltanto valori numerici interi e positivi da 1 ( orbitale più vicino al nucleo ) in poi. Ad esempio, n=1, 2, 3, ...
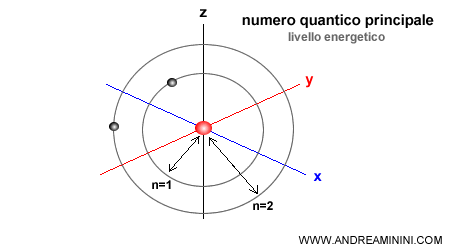
Quanto più alto è il numero quantico principale ( n ) tanto più grande è la distanza media dell'elettrone dal nucleo e tanto maggiore è il suo livello energetico.
Ogni valore del numero quantico individua uno strato elettronico.
Il numero quantico secondario ( azimutale )
Il numero quantico azimutale ( l ) indica la forma dell'orbitale ed è legato al modulo del momento angolare orbitale dell'elettrone rispetto al nucleo.
Questo numero quantico secondario definisce il numero dei sottolivelli orbitali di ciascun livello energetico ( n ).
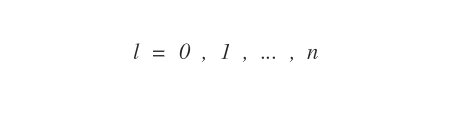
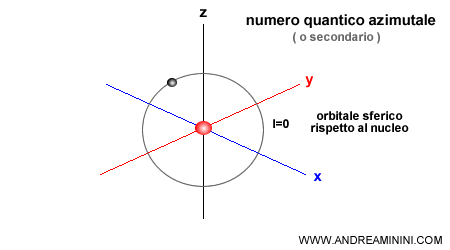
Può assumere valori interi positivi a partire da 0 a n-1. La rappresentazione seguente mostra uno dei casi più semplici possibili. Il valore zero ( l=0 ) indica che l'orbitale ha una forma simmetrica sferica.
Il valore uno ( l=1 ) indica che l'orbitale ha una forma allungata e asimmetrica ( non sferica ) ed è decentrato rispetto al nucleo. Al crescere del valore ( l ) la forma dell'orbitale diventa sempre più asimmetrica e allungata o comunque più complicata.
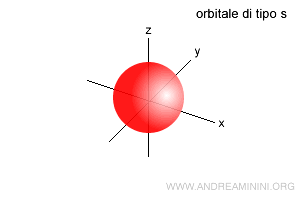
- Orbitale di tipo s ( l=0 ). C'è un solo sottolivello e un solo orbitale simmetrico di forma sferica intorno al nucleo. Può ospitare 2 elettroni.
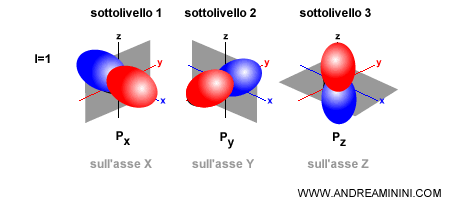
- Orbitale di tipo p ( l=1 ). Ci sono tre sottolivelli. Ogni sottolivello può ospitare due elettroni, ha forma asimmetrica a doppio lobo ed è disposto nello spazio intorno al nucleo su un asse cartesiano (x, y, z). L'orientazione è individuata dal numero quantico magnetico (-1,0,+1). Gli orbitali di tipo p possono ospitare al massimo 6 elettroni (2 per ogni sottolivello). Ogni orbitale è una regione nello spazio su tre dimensioni, non è una figura piana a due dimensioni. Quindi, è preferibile indicare gli orbitali come volumi di spazio colorati in modo diverso.
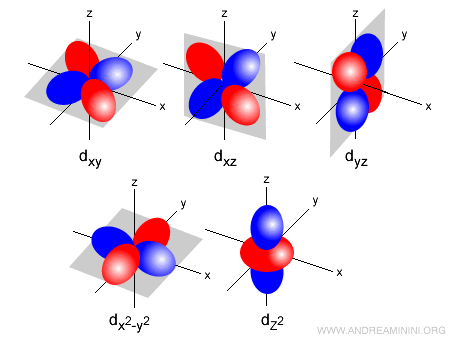
- Orbitale di tipo d ( l=2 ). Ci sono cinque sottolivelli possibili. Ogni sottolivello può ospitare 2 elettroni e ha forma asimmetrica a quattro lobi ( tetralobale ) su un piano nodale. L'orientazione è individuata dal numero quantico magnetico (-2,-1,0,+1,+2). Gli orbitali di tipo d possono ospitare al massimo 10 elettroni (2 per ogni sottolivello). Nello spazio le regioni orbitali di tipo d si presentano all'incirca in questo modo:
- Orbitale di tipo f ( l =3 ). E' composto da sette sottolivelli. Ogni sottolivello ha forma, orientazione diversa dagli altri. L'orientazione è individuata dal numero quantico magnetico (-3.-2,-1,0,+1,+2,+3). Gli orbitali di tipo d possono ospitare al massimo 14 elettroni (2 per ogni sottolivello).
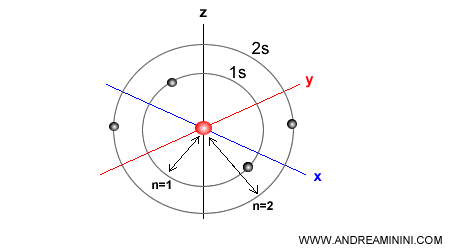
Nota. I sottolivelli con lo stesso numero quantico azimutale hanno la stessa forma. Ad esempio, tutti quelli che hanno l=0 hanno forma sferica. Il livello energetico 1 ha un orbitale di tipo s (sferico) detto 1s. Il livello energetico n=2, più esterno rispetto al precedente, ha un orbitale di tipo s (sferico) detto 2s. E via dicendo.
Il numero quantico magnetico
Il numero quantico magnetico ( m ) determina l'orientazione dell'orbitale rispetto agli assi cartesiani. E' legato al momento angolare dell'orbitale lungo l'asse z.
Definisce il numero di orbitali in ciascun sottolivello e il loro orientamento nello spazio.
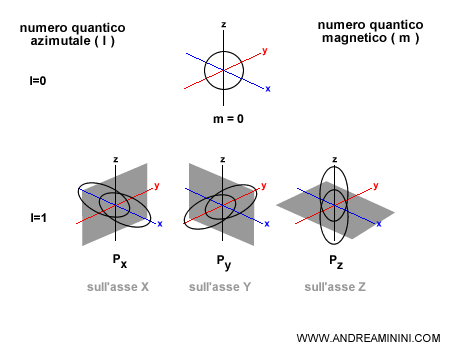
Il numero quantico ( m ) può assumere un valore compreso tra l e -l, compreso lo zero.
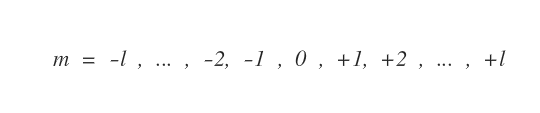
Esempio. Se l=1 allora i sottolivelli orbitali a doppio lobo ( orbitali di tipo P ) possono avere tre orientazioni possibili sull'asse X, sull'asse Y e sull'asse Z ( m=-1, 0, +1 ). Viceversa se l=0 allora c'è un orbitale sferico che ha una sola orientazione ( m=0 ).
La relazione tra numero quantico principale, secondario e magnetico
Tra il numero quantico principale ( n ), azimutale ( l ) e quello magnetico ( m ) si instaura una relazione diretta.
Nei primi quattro livelli energetici dell'atomo le combinazioni possibili sono le seguenti:
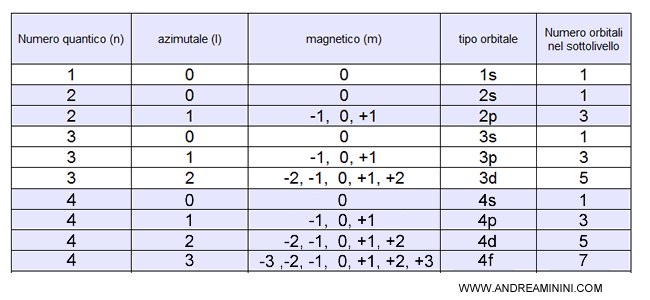
Nota. Ogni orbitale di qualsiasi tipo può ospitare al massimo 2 elettroni. Pertanto, per conoscere il numero degli elettroni di un sottolivello basta moltiplicare per due il numero di orbitali nel sottolivello. Ad esempio, il sottolivello 4f ha 7 orbitali, quindi può ospitare al massimo 14 elettroni (2 per ogni orbitale). Il livello energetico 4 può ospitare al massimo (1+3+5+7)·2 = 32 elettroni.
Il numero quantico di spin
Inizialmente si pensava che il numero quantico di spin fosse una rotazione dell'elettrone su se stesso, sul proprio asse. Questa è però una semplificazione che non rende bene l'idea dello spin.
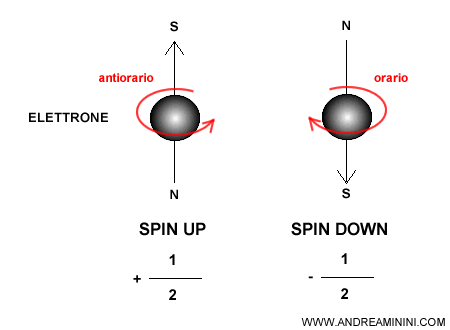
In realtà lo spin è una grandezza quantizzata, una proprietà intrinseca della particella come la massa o la carica. Non va inteso come una vera rotazione dell’elettrone attorno al proprio asse.
Matematicamente, lo spin è un momento angolare intrinseco che non trova un analogo nella fisica classica.
Cosa significa? Il momento angolare intrinseco è un tipo di momento angolare che appartiene alla particella per natura, indipendentemente da qualunque moto nello spazio. Si distingue dal momento angolare orbitale, che invece dipende dal moto di una particella attorno a un punto o a un asse.
Per l’elettrone, il numero quantico di spin $s$ è sempre $s = \tfrac{1}{2}$.
La sua proiezione lungo un asse scelto (in genere l’asse $z$) può assumere solo due valori chiamati convenzionalmente spin up e spin down:
- $ m_s = +\tfrac{1}{2} $ (spin up)
- $ m_s = -\tfrac{1}{2} $ (spin down)
Questi due valori non descrivono un verso di rotazione fisico, ma il risultato possibile di una misura. Sono associati a un momento magnetico intrinseco in cui l’elettrone si comporta come un minuscolo magnete.
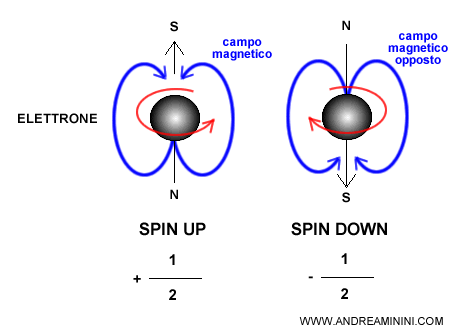
Quando la proiezione dello spin è $ m_s = +\tfrac{1}{2} $ il momento magnetico è orientato in un verso (convenzione: spin up), mentre per $ m_s = -\tfrac{1}{2} $ è orientato nel verso opposto (spin down).
Per questo motivo, in un esperimento come quello di Stern-Gerlach, un fascio di elettroni si separa in due direzioni distinte.
Qual è la differenza tra il momento angolare intrinseco e il momento magnetico intrinseco?
Lo spin (momento angolare intrinseco) è una grandezza meccanico-quantistica che misura la natura rotazionale intrinseca della particella.
Il momento magnetico intrinseco, invece, è una grandezza elettromagnetica che misura la tendenza della particella a comportarsi come un dipolo magnetico.
In breve: lo spin è la causa, il momento magnetico è l’effetto tramite la carica elettrica.
Nota. A livello intuitivo, si può immaginare che due elettroni con lo stesso spin si comportino come calamite parallele che si respingono, mentre due con spin opposto si compensano a vicenda. È però solo un’analogia didattica: la vera ragione risiede nella natura quantistica degli elettroni come fermioni e nella simmetria delle loro funzioni d’onda.
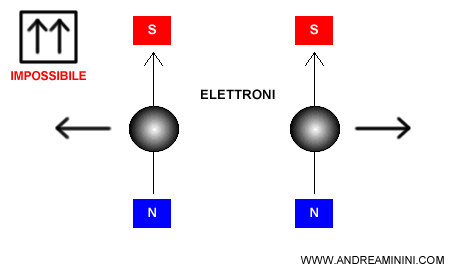
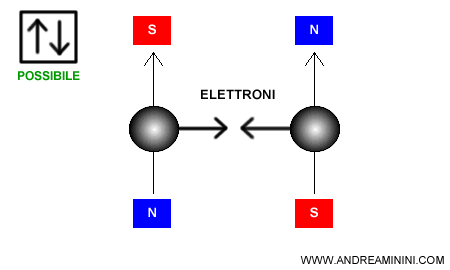
Il principio di esclusione di Pauli stabilisce che due elettroni non possono avere gli stessi quattro numeri quantici.
Quindi, nello stesso orbitale (stessi $n, l, m $) possono esserci al massimo due elettroni con spin opposto ($ m_s = +\tfrac{1}{2}$ e $ m_s = -\tfrac{1}{2}$).
Questa regola si rappresenta di solito con un quadrato che raffigura le combinazioni possibili di spin degli elettroni in un orbitale.
- Un elettrone spin up

- Due elettroni, spin up e spin down

Ovviamente c'è anche una terza combinazione oltre alle precedenti, quella in cui non c'è nemmeno un elettrone nell'orbitale: un quadrato vuoto. E' però una combinazione banale e può essere omessa.
Un esempio pratico. L'orbitale 1s ha al massimo 2 elettroni, un elettrone con spin up e un altro elettrone con spin down. Lo stesso accade nell'orbitale 2s e in qualsiasi altro orbitale dell'atomo (2p, 3s, 3p, 3d, ecc ) .
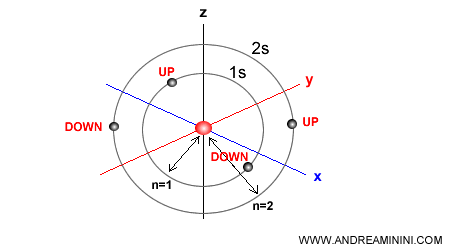
E così via.
