La regola dell'ottetto
Cos'è la regola dell'ottetto
Ogni atomo tende a cedere, acquisire o mettere in comune gli elettroni di valenza per raggiungere la configurazione elettronica superficiale del gas nobile più vicino.
I gas nobili hanno generalmente otto elettroni di valenza negli orbitali più esterni (s+p).
Ad esempio, ecco la configurazione elettronica del neon.
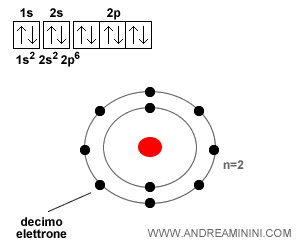
In qualsiasi atomo gli elettroni di valenza sono al massimo otto.
Pertanto, gli atomi tendono a raggiungere una configurazione esterna superficiale di 8 elettroni.
Da questo deriva il nome "regola dell'ottetto".
Nota. Tra i gas nobili fa eccezione l'elio che ha soltanto due elettroni di valenza nell'orbitale s. Quindi, gli elementi più vicini al numero atomico dell'elio (es. idrogeno e litio) tendono a raggiungere una configurazione superficiale composta da 2 elettroni anziché 8.
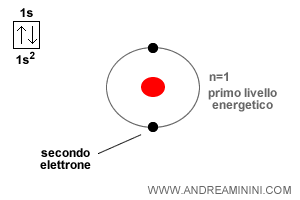
La regola dell'ottetto venne scoperta dal chimico statunitense Lewis.
E' valida per gran parte degli elementi rappresentativi. Non è invece osservata negli elementi di transizione.
Esempio
Un atomo di ossigeno ha una configurazione elettronica superficiale composta da 6 elettroni (2s22p4), due nell'orbitale 2s e quattro nell'orbitale 2p.
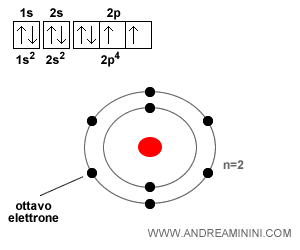
Per raggiungere lo stato elettronico del gas nobile più vicino (neon), l'atomo di ossigeno deve acquisire due elettroni.
Ad esempio, un atomo di ossigeno (O) si lega facilmente con due atomi di idrogeno (H) ognuno dei quali cede un elettrone di valenza, formando una molecola di acqua.
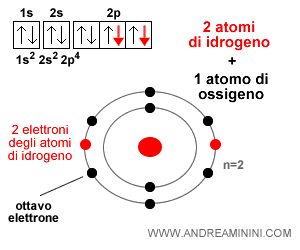
Nota. Per questa ragione la formula chimica dell'acqua è H2O ossia due atomi di idrogeno e un atomo di ossigeno. $$ H_2 O $$
Le eccezioni alla regola dell'ottetto
La regola dell'ottetto è applicata per gran parte dei legami.
Tuttavia, esistono anche composti in cui gli atomi non soddisfano la regola dell'ottetto.
- Numero dispari di elettroni di valenza
Se la somma degli elettroni di valenza degli atomi presenti in una molecola è un numero dispari, uno o più atomi non completano l'ottetto. Ad esempio, l'ossido di azoto (NO).
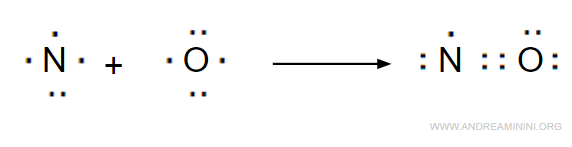
- L'espansione dell'ottetto
In alcune molecole gli atomi formano più di 4 coppie di legame, quindi hanno più di 8 elettroni.
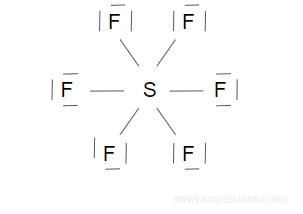
- La sollecitazione degli elettroni
Una sollecitazione energetica degli elettroni può comportare il salto di uno o più elettroni dagli orbitali di tipo s oppure p agli orbitali più esterni di tipo d. Il salto modifica il numero di legami chimici che l'atomo può formare con gli altri atomi della molecola.
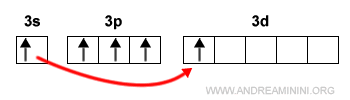
E così via.
