L'atomo quantistico
L'atomo quantistico è formato da un nucleo centrale a da diversi strati ( livelli energetici ) in cui orbitano gli elettroni.
I livelli energetici
I livelli energetici sono ordinati secondo una serie di numeri interi. Il livello energetico più interno e vicino al nucleo è quello più basso ed è associato al numero uno ( n=1 )
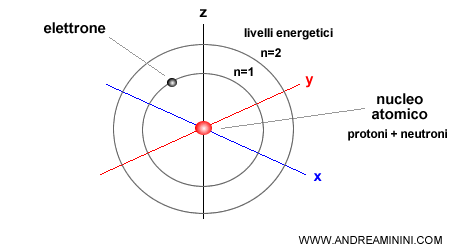
Il livello energetico successivo è associato al numero due ( n=2 ) e ha una quantità di energia superiore al primo, e così via fino all'ultimo strato più esterno ( n ) dello spazio atomico.
L'ultimo livello energetico più esterno ( n ) è anche quello più intenso.
Il parametro che misura il livello energetico è detto numero quantico.
Gli orbitali
Un livello energetico è composto da uno o più orbitali che identificano le orbite seguite dagli elettroni nel loro moto intorno al nucleo.
Sono detti sottolivelli energetici perché hanno lo stesso valore di energia del livello energetico.
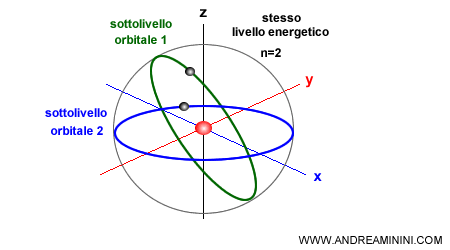
Ogni singolo sottolivello energetico orbitale ha una forma diversa e un'orientazione differente rispetto agli altri orbitali dello stesso livello energetico ( n ). Pur avendo lo stesso livello di energia.
Nota. Gli orbitali non devono essere necessariamente di forma circolare. Inoltre, possono anche essere decentrati rispetto al nucleo atomico.
La configurazione elettronica
La disposizione degli elettroni negli orbitali intorno al nucleo atomico è detta configurazione elettronica e determina le proprietà chimiche dell'atomo ossia la possibilità di creare dei composti.
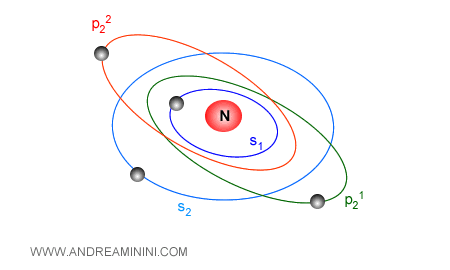
Gli orbitali degli elettroni sono caratterizzati dai seguenti parametri o numeri quantici
- Il numero quantico principale ( n )
- Il numero quantico secondario o azimutale ( l )
- Il numero quantico magnetico ( m )
- l numero quantico di spin ( ms )
Esempio. Gli atomi di due elementi chimici differenti che hanno lo stesso numero di elettroni nel livello energetico esterno ( elettroni di valenza ) su un orbitale di tipo s ( circolare ) hanno proprietà chimico-fisiche simili anche se appartengono livelli energetici diversi ( es. 2s e 4s ).
