L'equilibrio liquido-vapore delle soluzioni
In una soluzione in equilibrio la composizione in fase vapore (y) è più ricca del componente più volatile rispetto alla composizione in fase liquida (x)
Una soluzione A+B è composta da un solvente A e da un soluto B.
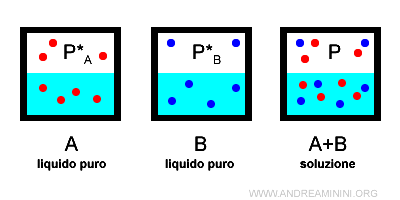
Nella soluzione A+B la composizione relativa del solvente (A) e del soluto (B) nella fase liquida è
$$ x_A + x_B = 1 $$
La composizione relativa del solvente (A) e del soluto (B) nella fase vapore è.
$$ y_A + y_B = 1 $$
In generale, le frazioni molari delle componenti di una soluzione in fase liquida (xA, xB) non coincidono con quelle in fase vapore (yA, yB).
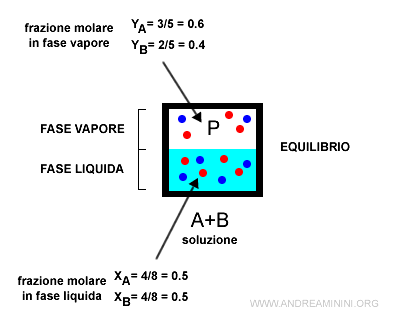
Pertanto, valgono le seguenti diseguaglianze.
$$ y_A \ne x_A $$
$$ y_B \ne x_B $$
La relazione tra le frazioni molari in fase vapore e in fase liquida di ogni componente della soluzione è la seguente:
$$ y_A = \frac{x_A}{x_A+\frac{P^*_B}{P^*_A} x_B} $$
$$ y_B = \frac{x_B}{\frac{P^*_A}{P^*_B} x_A+ x_B} $$
Dove p*A e p*B sono le pressioni di vapore di A e B come liquido puro a parità di temperatura.
Da queste formule si deduce che la composizione in fase vapore della soluzione è più ricca del componente più volatile.
Nota. Se il componente A è più volatile di B, allora P*A>P*B. Di conseguenza il denominatore che determina yA è più basso e yA>xA. E viceversa.
La dimostrazione
Secondo la legge di Dalton sui gas (o legge delle pressioni parziali) la pressione P esercitata dai vapori che sono in equilibrio con la soluzione è uguale alla somma delle pressioni parziali dei componenti A e B in fase vapore (PA+PB).
$$ P = P_A + P_B $$
Secondo la legge di Raoult la pressione parziale esercitata da un componente in fase vapore (es. PA) è uguale al prodotto della pressione vapore del componente A come sostanza pura (es. P*A) per la sua frazione molare nella soluzione in fase liquida (es. xA).
$$ P_A = P^*_A \cdot x_A $$
$$ P_B = P^*_B \cdot x_B $$
Dove p*A e p*B sono le pressioni di vapore di A e B come liquido puro a una data temperatura.

Pertanto, il contributo alla pressione che i componenti danno in equilibrio è proporzionale alla loro frazione molare in fase liquida.
Sostituendo le formule di PA e PB della legge di Raoult nella legge di Dalton ottengo
$$ P = P_A + P_B $$
$$ P = P^*_A \cdot P^*_B \cdot x_B $$
La pressione del vapore in equilibrio con una soluzione (tensione di vapore della soluzione) è la media pesata delle tensioni di vapore dei singoli componenti per le rispettive frazioni molari.
Anche nella miscela gassosa vale la legge di Dalton
$$ P = P_A+P_B $$
Seguendo lo stesso ragionamento, nella miscela gassosa la pressione parziale di un componente (PA e PB) è uguale alla pressione totale della miscela per la frazione molare del componente in fase vapore (yA e yB)
$$ P_A = P \cdot y_A $$
$$ P_B = P \cdot y_B $$
In questo caso le frazioni molari yA e yB sono relativi alla fase aeriforme

Mettendo insieme tutte equazioni emerge che le pressioni parziali PA e PB sono uguali a
$$ P_A = P^*_A \cdot x_A = P \cdot y_A $$
$$ P_B = P^*_B \cdot x_B = P \cdot y_B $$
ottengo così due equazioni
$$ P^*_A \cdot x_A = P \cdot y_A $$
$$ P^*_B \cdot x_B = P \cdot y_B $$
Metto in evidenza YA e YB nelle due equazioni portandoli al primo membro
$$ y_A = \frac{P^*_A}{P} \cdot x_A $$
$$ y_B = \frac{P^*_B}{P} \cdot x_B $$
Nota. Dal punto di vista esclusivamente matematico, se il rapporto P*A/P è maggiore di uno, la frazione yA è maggiore di xA. $$ \frac{P^*_A}{P} > 1 \Rightarrow y_A > x_A $$ Se il rapporto P*A/P è minore di uno, la frazione yA è minore di xA. $$ \frac{P^*_A}{P} < 1 \Rightarrow y_A < x_A $$ Se il rapporto P*A/P è uguale a uno, la frazione yA è uguale a xA. $$ \frac{P^*_A}{P} = 1 \Rightarrow y_A = x_A $$ Lo stesso vale per il componente B.
Pertanto, se yA > xA ne consegue che P*A > P
Sapendo che la pressione totale P è
$$ P = p*_Ax_A + p*_Bx_B $$
Le frazioni molari xA e xB sono un numero compreso tra 0 e 1.
Essendo una soluzione xA e XB sono diverse da zero (e da uno).
Quindi, se P*A > P necessariamente xA deve essere inferiore rispetto a yA.
$$ \color{red}{P} = \color{red}{P*_A}x_A + p*_Bx_B $$
In caso contrario l'equazione non potrebbe essere soddisfatta.
E questo dimostra la diversa composizione in fase vapore rispetto alla fase liquida.
Nota. Lo stesso ragionamento posso ripeterlo sul componente B della soluzione giungendo allo stesso risultato.
Ora devo dimostrare che il componente più volatile ha una composizione più alta in fase vapore rispetto alla fase liquida.
Riprendo le formule della frazione molare in fase vapore di A e B
$$ y_A = \frac{P^*_A}{P} \cdot x_A $$
$$ y_B = \frac{P^*_B}{P} \cdot x_B $$
Prendo in considerazione soltanto il componente A.
$$ y_A = \frac{P^*_A}{P} \cdot x_A $$
Dove P=PA+PB
$$ y_A = \frac{P^*_A}{P_A+P_B} $$
Sapendo che PA=P*AXA e PB=P*BXB
$$ y_A = \frac{P^*_A x_A}{P^*_A x_A+P^*_B x_B} $$
Divido entrambi i membri per P*A
$$ y_A = \frac{x_A}{x_A+\frac{P^*_B}{P^*_A} x_B} $$
Ora è più evidente che se A è il componente più volatile (P*A>P*B) la frazione molare in fase vapore è maggiore rispetto alla sua fase liquida yA>xA. E viceversa
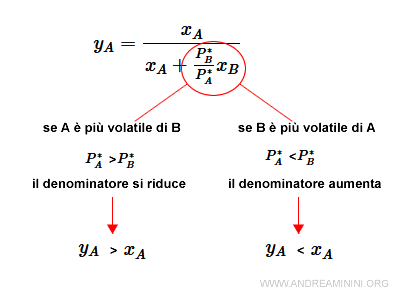
La stessa formula posso ricavarla per il componente B con le stesse considerazioni.
$$ y_B = \frac{x_B}{\frac{P^*_A}{P^*_B} x_A+ x_B} $$
Pertanto, il componente più volatile della soluzione ha una frazione molare in fase vapore più alta rispetto alla fase liquida.
Nota. Questo aspetto è alla base del processo di distillazione frazionata di un liquido. A temperatura e pressione costanti, la composizione in fase vapore è più ricca del componente più volatile. Raccogliendo e condensando i vapori si ottiene un liquido più ricco del componente più volatile. Ripetendo la distillazione, si riduce progressivamente nel liquido condensato la frazione molare del componente meno volatile.
Come rappresentare l'equilibrio liquido-vapore
Posso rappresentare l'equilibrio liquido-vapore in un diagramma cartesiano in cui sulle ordinate misuro la pressione e sulle ascisse la frazione molare di un componente.
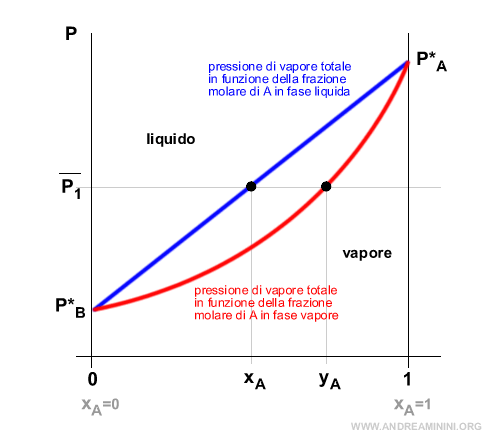
L'intervallo delle frazioni molari sull'asse delle ascisse è compreso tra 0 e 1 perché la somma di xA + xB = 1.
I punti estremi 0 e 1 coincidono con le sostanze pure.
- In xA=0 nella soluzione non c'è traccia del componente A. Poiché xB=1-xA in questo punto c'è soltanto il componente B allo stato puro ossia al 100%. La pressione totale P coincide con la pressione del componente B allo stato liquido puro (P=P*B).
- In xA=1 nella soluzione c'è soltanto il componente A allo stato puro ossia al 100%. Non c'è traccia del componente B. La pressione totale P coincide con la pressione del componente A allo stato liquido puro (P=P*A).
Nota. Il componente A è più volatile del componente B perché allo stato puro (xA=1) la sua pressione in fase liquida P*A è più alta della pressione in fase liquida P*B del componente B allo stato puro (xA=0).
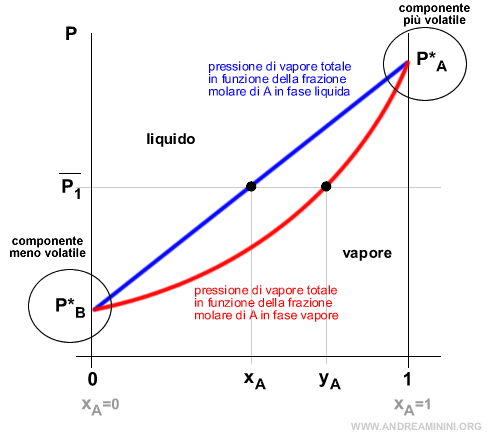
Tra i due punti 0 e 1 traccio la curva delle variazioni di pressione al variare delle frazioni molari in fase liquida (colore blu).
Poi traccio la curva delle variazioni di pressione delle frazioni molari in fase vapore (colore rosso).
Essendo una soluzione in equilibrio, la temperatura e la pressione sono costanti.
Ad esempio considero la pressione costante a P1.
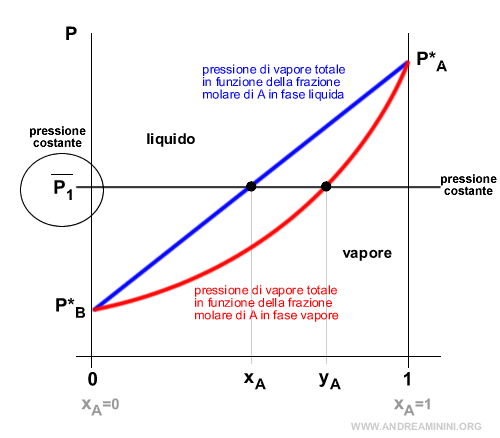
A parità di pressione (P1) la frazione molare in fase vapore di A è più alta della frazione molare in fase liquida di A.
$$ y_A > x_A $$
Questo accade perché il componente A è più volatile del componente B ossia P*A>P*B.
Isopleta
L'isopleta è una retta verticale e ortogonale all'asse delle ascisse che fissa la frazione molare dei componenti A e B della soluzione (composizione costante del sistema) al variare della pressione. In greco "isopleta" significa uguale abbondanza.
In questo esempio fisso la composizione della soluzione a XA.
Pertanto, la frazione molare del componente B è XB=1-XA.
Alla pressione P1 la composizione XA si trova nell'area della fase vapore della soluzione (punto A).
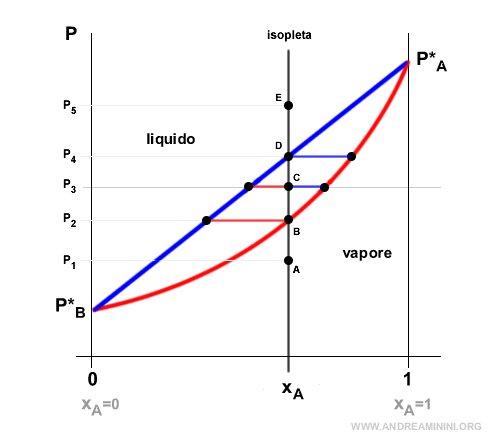
Aumento la pressione del sistema a P2,
Il sistema si trova sulla curva di equilibrio in fase vapore (punto B). Quindi, il sistema è ancora in fase vapore.
Alla pressione P3 il sistema si trova nell'intervallo (punto C) tra la curva di equilibrio in fase liquida blu e la curva di equilibrio in fase vapore rossa.
In questo caso la soluzione è in parte in fase liquida e in parte in fase vapore.
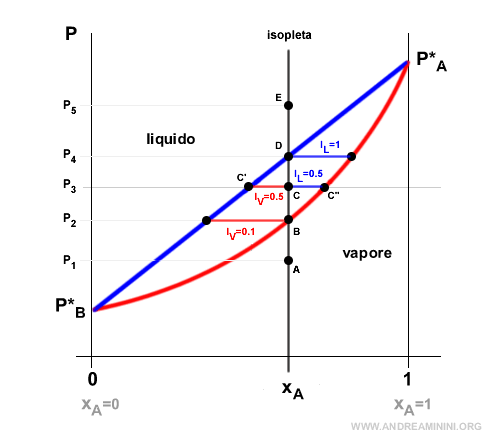
Il segmento C'C" che separa le due curve di equilibrio in relazione al punto C mi permette anche di capire qual è la proporzione all'equilibrio della fase vapore e della fase liquida.
- IV=C'C/C'C" è la proporzione all'equilibrio in fase vapore.
- IL=CC"/C'C" è la proporzione all'equilibrio in fase vapore.
In questo caso IV=0.5 e IL=0.5. Pertanto, alla pressione P3 la composizione XA in equilibrio è per metà in fase vapore e l'altra metà in fase liquida.

Alla pressione P4 il sistema si trova sulla curva di equilibrio in fase liquida (punto D).
In questo caso la composizione XA della soluzione è in fase liquida. Non ci sono moli in equilibrio in fase vapore o al massimo sono poche tracce.
La proporzione IL=1 tra le due curve è uguale a 1. Quindi, la prorzione IV=0 è nulla.
Nota. Una situazione simile ma opposta si verifica nel punto B già analizzato dove IV=1 e IL=0 e la proporzione all'equilibrio è totalmente in fase vapore con poche tracce in fase liquida.
Infine, alla pressione P5 il sistema si trova nell'area della fase liquida della soluzione (punto E).
Pertanto, la soluzione è ancora in fase liquida.
E così via
