I metalli, i semimetalli e i non metalli
Gli elementi chimici della tavola periodica si distinguono in metalli, non metalli e semimetalli a seconda delle varie proprietà chimico-fisiche.
Questa ripartizione è molto importante perché dalla combinazione di metalli e non metalli derivano vari composti chimici.
Metalli
Gran parte degli elementi chimici sono metalli.
Cosa sono i metalli?
I metalli sono elementi che tendono a perdere gli elettroni, trasformandosi in ioni positivi, per raggiungere la configurazione elettronica superficiale stabile del gas nobile più vicino per numero atomico.
Sono anche elettropositivi perché tendono a trasformarsi in ioni positivi
Nella tavola periodica sono metalli gli elementi che occupano la parte sinistra e centrale. Li ho colorati in celeste.
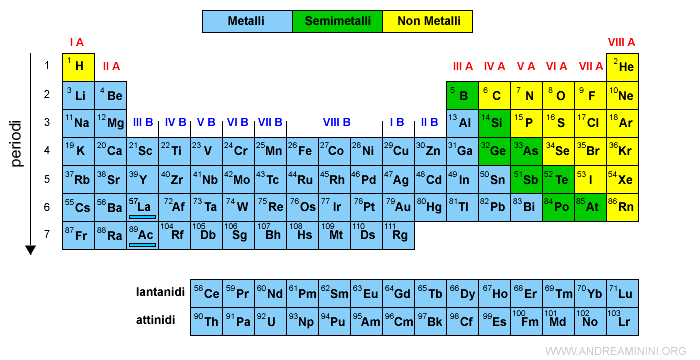
Gli elementi del gruppo I A sono detti metalli alcalini mentre quelli del gruppo II A sono detti metalli alcalino-terrosi.
I metalli dei gruppi B sono detti genericamente metalli di transizione.
Nota. Il carattere metallico degli elementi si riduce spostandosi da sinistra verso destra sullo stesso periodo (numero quantico principale) e aumenta con il periodo spostandosi dall'alto verso il basso all'interno dello stesso gruppo. Il carattere metallico si riduce anche con l'aumentare del numero di ossidazione.
Quali sono le caratteristiche dei metalli?
Gran parte dei metalli si presentano allo stato solido in condizioni normali.
Nota. Fa eccezione soltanto il mercurio che si presenta allo stato liquido perché ha il punto di fusione a -39°.
Hanno un basso livello di energia di ionizzazione e di elettronegatività.
Altre caratteristiche sono un una buona lucentezza e deformabilità, sono duttili e malleabili.
Nota. La malleabilità è la capacità di essere ridotti in lamini sottili mentre la duttilità è la capacità di essere tirati in fili.
Hanno una buona conducibilità termica ed elettrica. Pertanto sono buoni conduttori.
I metalli possono esistere nelle soluzioni acquose come ioni positivi semplici idratati (es. Na+).
Nota. I metalli hanno altre caratteristiche molto variabili. Alcuni sono molto duri (ferro) mentre altri sono teneri (metalli alcalini). Alcuni metalli fondono a basse temperature mentre altri ad elevate temperature (tungsteno).
Non metalli
Cosa sono i non metalli?
I non metalli sono elementi che tendono ad acquistare gli elettroni, trasformandosi in ioni negativi, per raggiungere la configurazione stabile del gas nobile più vicino per numero atomico.
Sono anche detti elettronegativi perché tendono a trasformarsi in ioni negativi.
In passato erano anche detti metalloidi.
I non metalli sono relativamente pochi. Nella tavola periodica occupano generalmente i posti alla destra della tavola periodica. Li ho colorati in giallo.

Sono non metalli i primi elementi dei gruppi IV A, V A VI A (calcogeni) e quelli del gruppo VII A (alogeni) e VIII A (gas nobili).
Nota. L'idrogeno è un non metallo anche se comunemente è indicato nel gruppo I A della tavola periodica. E' l'unica eccezione.
Quali sono le caratteristiche dei non metalli?
Sono prevalentemente allo stato aeriforme in condizioni di temperatura e pressione normali.
Alcuni non metalli sono allo stato liquido (bromo) mentre altri sono solidi (iodio, zolfo e fosforo).
Hanno elevati livelli di energia di ionizzazione e di elettronegatività.
Altre caratteristiche dei non metalli sono la scarsa lucentezza e la fragilità, in quanto sono poco deformabili.
Generalmente hanno una scarsa conducibilità termica ed elettrica. Pertanto, sono buoni isolanti.
I non metalli possono esistere nelle soluzioni acquose come ioni negativi semplici idratati (CL-) oppure come ioni positivi accoppiati a un altro elemento (es. NH4+).
Semimetalli
Cosa sono i semimetalli?
I semimetalli sono elementi chimici con caratteristiche intermedie tra i metalli e i non metalli.
In determinate condizioni i semimetalli si comportano come metalli mentre in altre come non metalli.
Nella tavola periodica occupano una diagonale che inizia da B e separa i metalli dai non metalli. Li ho colorati in verde.

Alcuni esempi di semimetalli sono il boro, il silicio, il germanio, l'arsenico, ecc.
Quali sono le caratteristiche dei semimetalli?
Sono semiconduttori perché presentano una conduzione elettrica intermedia tra i metalli (conduttori) e i non metalli (isolanti).
La regola di Sanderson
La regola di Sanderson permette di distinguere rapidamente tra metalli, non metalli e semimetalli.
- Sono metalli gli elementi con un numero di elettroni (m) nel livello energetico più esterno uguale o inferiore al periodo (n). $$ n-m \ge 0 $$
- Sono semimetalli gli elementi in cui la differenza tra il periodo (n) e il numero di elettroni (m) nel livello energetico più esterno è -2 oppure -1. $$ -2 < n-m < 0 $$
- Sono non metalli tutti gli altri elementi chimici che non soddisfano le precedenti regole. $$ n-m <-2 $$
Eccezioni. L'idrogeno è un elemento che fa eccezione alla regola di Sanderson in quanto, pur avendo un numero di elettroni uguale al periodo n=m=1, l'idrogeno è un non metallo. Inoltre, la differenza nulla n-m=0 è dubbia. Il più delle volte si tratta di metalli ma anche alcuni semimetalli hanno una differenza n-m=0. Ad esempio, il germanio (Ge), l'antimonio (An) e il polonio (Po) sono semimetalli pur avendo n-m=0.
Esempio
L'arsenico (As) si trova nel periodo 4 e ha la configurazione superficiale 3d10 4s2 4p3.
Nel livello energetico più esterno (n=4) l'arsenico ha m=5 elettroni, due nell'orbitale 4s e tre negli orbitali 4p.
La differenza n-m è -1.
$$ n - m = 4 - 5 = -1 $$
Quindi, l'arsenico è un semimetallo.
E così via
