Entropia standard di variazione
L'entropia standard di reazione ΔS° è la differenza tra la somma delle entropie standard dei prodotti e la somma delle entropia standard dei reagenti di una reazione chimica
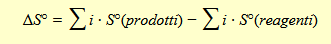
Dove i sono i coefficienti stechiometrici di ogni singola specie della reazione.
Ogni specie dei reagenti e dei prodotti viene sostituito con il suo valore di entropia molare standard moltiplicato per il coefficiente stechiometrico.
A seconda dei casi, l'entropia standard di reazione ΔS° può essere positiva o negativa.
In genere, la variazione di entropia standard di reazione è positiva se aumentano le molecole delle specie gassose nei prodotti, perché l'aumento del volume incrementa il grado di disordine del sistema ( entropia ). E viceversa.
Nota. Se la reazione chimica è una reazione di formazione di una sostanza, la variazione ΔS° è detta entropia standard di formazione del composto. A volte si indica con una f in pedice ΔS°f.
Un esempio pratico
Esempio 1
Devo calcolare l'entropia di reazione di questa reazione semplice reazione chimica
$$ H_2 O(g) \rightarrow H_2(g) + \frac{1}{2} O_2(g) $$
L'entropia di reazione della reazione è uguale alla differenza tra i valori di entropia standard dei prodotti e dei reagenti.
$$ ΔS°= [S°(H_2) - \frac{1}{2} S°(O_2)] - S°(H_2O) $$
Sostituisco le specie con i relativi valori di entropia molare standard.
$$ ΔS°=[ 130,68 \: J \: K^{-1} \: mol^{-1} + \frac{1}{2} \cdot 205,14 \: J \: K^{-1} \: mol^{-1} ] - 188,83 \: J \: K^{-1} \: mol^{-1} $$
Poi svolgo i calcoli algebrici.
$$ ΔS°= 44,42 \: J \: K^{-1} \: mol^{-1} $$
Il risultato è la variazione di entropia standard ΔS° della reazione chimica.
E' un valore positivo perché il numero delle molecole gassose aumenta da 1 a 1.5, nei reagenti c'è una molecola gassosa (H2O) mentre nei prodotti c'è una molecola gassosa (H2) e mezza (O2).
Pertanto, aumenta il grado di disordine del sistema ossia l'entropia.
Esempio 2
Ora calcolo la variazione di entropia in una reazione chimica inversa alla precedente, ossia la reazione di formazione di una molecola di acqua allo stato aeriforme.
$$ H_2(g) + \frac{1}{2} O_2(g) \rightarrow H_2 O(g) $$
$$ ΔS°= S°(H_2O) - [S°(H_2) - \frac{1}{2} S°(O_2)] $$
$$ ΔS°=188,83 \: J \: K^{-1} \: mol^{-1} - [ 130,68 \: J \: K^{-1} \: mol^{-1} + \frac{1}{2} \cdot 205,14 \: J \: K^{-1} \: mol^{-1} ] $$
$$ ΔS°= -44,42 \: J \: K^{-1} \: mol^{-1} $$
Il risultato è la variazione di entropia standard ΔS° della reazione chimica.
In questo caso è un valore negativo, perché il numero delle molecole gassose diminuisce da 1.5 a 1, nei reagenti c'è una molecola gassosa (H2) e mezza (O2) mentre nel prodotto c'è una sola molecola gassosa (H2O).
Quindi, il grado di disordine del sistema si riduce.
E così via.
