La teoria degli orbitali molecolari
Secondo la teoria degli orbitali molecolari, quando si forma una molecola gli orbitali degli atomi che la compongono si sovrappongono e si trasformano in orbitali della molecola.
La molecular orbitals theory (MO) è stata elaborata nel 1927 da E.V. Condon, W. Heitler e F. London.
E' una teoria più precisa ma anche molto più complessa.
La molecola assume una struttura simile a quella di un atomo con due o più orbitali intorno ai nuclei.
Nota. A differenza degli orbitali atomici, gli orbitali molecolari sono policentrici perché orbitano intorno a due o più atomi. Gli orbitali atomici sono, invece, monocentrici perché orbitano intorno a un atomo.
Ogni orbitale molecolare è descritto da una funzione matematica d'onda Ψ.
Il valore dell'energia di un orbitale molecolare corrisponde all'energia necessaria per allontanare un elettrone dall'orbitale.
La differenza tra orbitali molecolari leganti e anti-leganti
- Dalla combinazione di due orbitali atomici si formano due orbitali molecolari (legante e anti-legante).
- Orbitale molecolare legante (o di legame
ha un livello di energia inferiore all'orbitale atomico iniziale. - Orbitale molecolare anti-legante
ha un livello di energia superiore all'orbitale atomico iniziale e si indica con un asterisco (*).
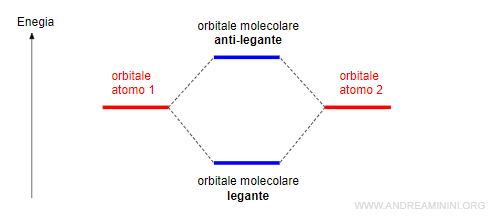
La presenza degli elettroni negli orbitali leganti favorisce la formazione del legame tra gli atomi.
Viceversa, la presenza degli elettroni negli orbitali anti-leganti ostacola la formazione del legame.
Pertanto, la molecola si forma soltanto se gli elettroni negli orbitali leganti sono più degli elettroni negli orbitali anti-leganti.
Nota. La semi differenza tra il numero di elettroni negli orbitali leganti (nl) e il numero degli elettroni negli orbitali anti-leganti (na) è detto ordine di legame (ol). $$ ol = \frac{n_l-n_a}{2} $$ Quanto maggiore è l'ordine di legame, tanto più forte è l'energia di legame e, di conseguenza, tanto più vicini sono gli atomi. Se l'ordine di legame è nullo la molecola non si forma. L'ordine di legame può assumere solo valori positivi (interi o frazionari) e nulli. Non può essere negativo.
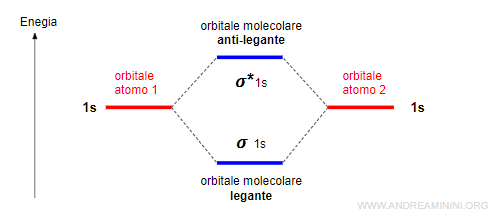
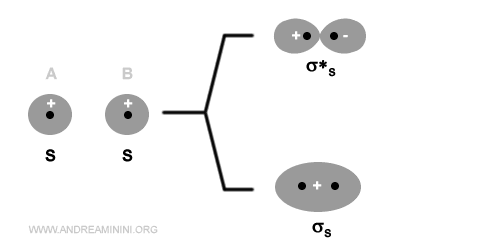
Gli orbitali sigma (σ) leganti e antileganti
Due orbitali atomici di tipo s oppure px generano due orbitali molecolari di tipo sigma, uno legante (σ) e l'altro anti-legante (σ*).
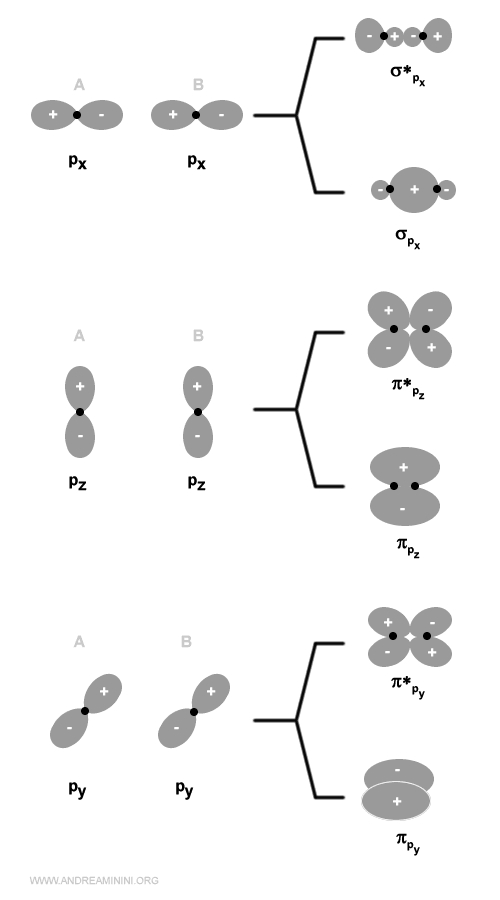
Gli orbitali p greco (π) leganti e antileganti
Due orbitali atomici di tipo p generano due orbitali molecolari di tipo sigma, uno legante (σ) e l'altro anti-legante (σ*) e quattro orbitali molecolari di tipo pi-greco, due leganti (πy e πz) e due anti-leganti (πy* e πz*).
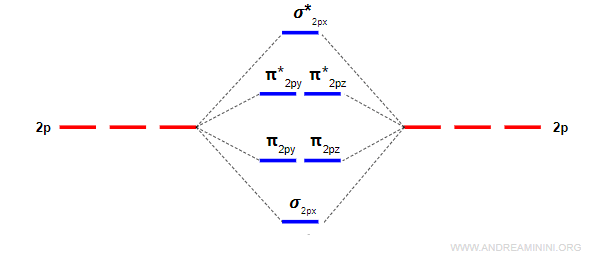
L'energia dell'orbitale σpx è più bassa rispetto agli orbitali πpy e πpz perché gli orbitali px si sovrappongono di più.
Il riempimento degli orbitali molecolari
Il riempimento degli orbitali molecolari segue le stesse regole degli orbitali atomici.
$$ σ_{1s} < σ^*{1s} < σ_{2s} < σ^*_{2s} $$
Gli elettroni si dispongono prima sugli orbitali a minore energia, quelli più stabili, e poi sugli altri.
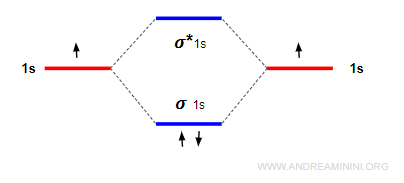
Nota. In quest'ultimo esempio l'ordine di legame è pari a 1 perché ci sono due elettroni nell'orbitale legante e zero nell'orbitale anti-legante. Pertanto, si forma un legame semplice. $$ ol = \frac{2-0}{2} = 1 $$
Ogni orbitale molecolare ha al massimo due elettroni con spin opposto, nel rispetto del principio di esclusione di Pauli.
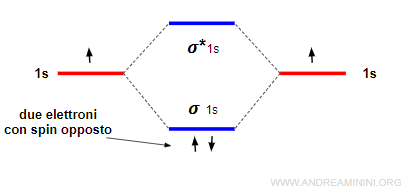
Gli elettroni si dispongono in ogni orbitale molecolare di pari energia con spin parallelo, nel rispetto della regola di Hund, poi occupano il secondo posto in ogni orbitale con spin opposto.
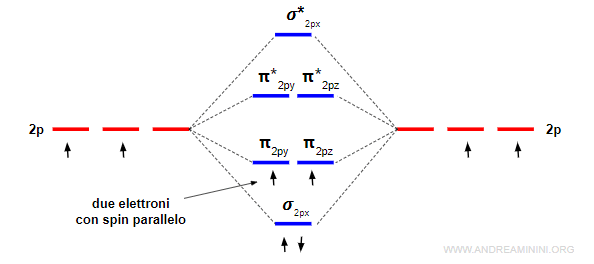
Il riempimento prosegue dal livello disponibile di energia più basso a quello più alto.
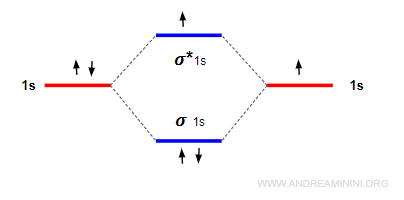
Nota. L'ordine di legame nell'esempio precedente è 1/2. Essendo positivo, la molecola si forma perché le forze leganti sono maggiori rispetto a quelle anti-leganti. $$ ol = \frac{2-1}{2} = \frac{1}{2} $$
Quando il numero degli elettroni negli orbitali leganti eguaglia quello degli elettroni anti-leganti, la molecola non si forma perché l'energia si bilancia.
In questo caso gli atomi restano isolati.
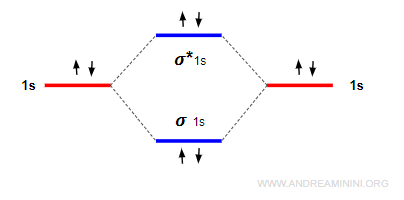
Nota. L'ordine di legame nell'esempio precedente è 0. Le forze leganti sono bilanciate da quelle anti-leganti. $$ ol = \frac{2-2}{2} = 0 $$
Gli elementi del secondo periodo
Gli elementi chimici del secondo periodo hanno anche gli elettroni negli orbitali atomici di tipo p.

Nota. Se la differenza di energia tra gli orbitali atomici 2s e 2p è contenuta, gli orbitali molecolari leganti σ2px e π2py,π2pz. possono anche scambiarsi di posto, perché una piccola variazione di energia può modificare la relazione d'ordine.
Quindi, l'ordine dei livelli di energia fino al secondo periodo è il seguente:

E' molto importante ricordarsi che gli orbitali πy e πz hanno lo stesso livello di energia. Lo stesso accade negli orbitali di anti-legame π*y e π*z.
In questi casi la relazione è di uguaglianza.
Nota. Gli orbitali con lo stesso livello di energia sono detti orbitali degeneri.
Le condizioni necessarie per formare una molecola
Gli orbitali atomici si combinano soltanto se sono rispettate alcune condizioni
- Energia confrontabile
Le energie degli atomi devono essere confrontabili. - Sovrapposizione orbitali atomici
Le nuvole elettroniche degli atomi devono sovrapporsi quanto più possibile.Nota. Da questa condizione deduco che la formazione del legame con gli orbitali atomici 1s è molto debole perché questi orbitali sono molto piccoli e la sovrapposizione è minore rispetto agli orbitali 2s o 3s.
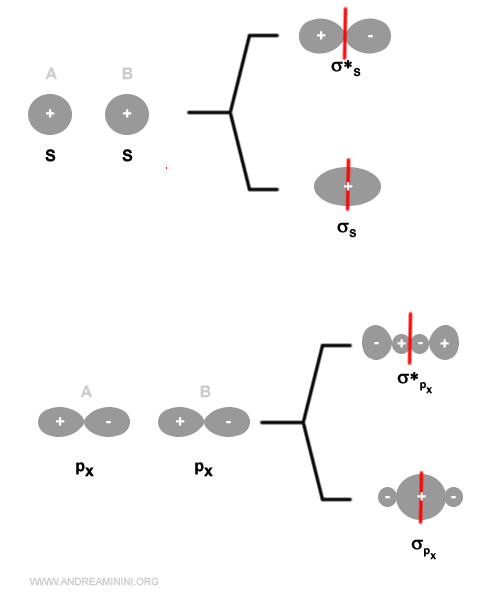
- Simmetria
Gli orbitali degli atomi siano simmetrici rispetto all'asse del legame della molecola.Esempio. Un orbitale di tipo s si combina con un orbitale di tipo s o px. Non si combina con gli orbitali di tipo py o pz.
Gli orbitali di tipo py o pz si combinano solo con orbitali dello stesso tipo.
Se queste condizioni non sono soddisfatte, gli atomi non si combinano oppure si combinano con un grado minimo.
Gli orbitali di tipo sigma
La combinazione di orbitali di tipo s o px genera sempre un orbitale molecolare di tipo sigma (σ) perché la densità elettronica è distribuita in modo simmetrico rispetto all'asse del legame.
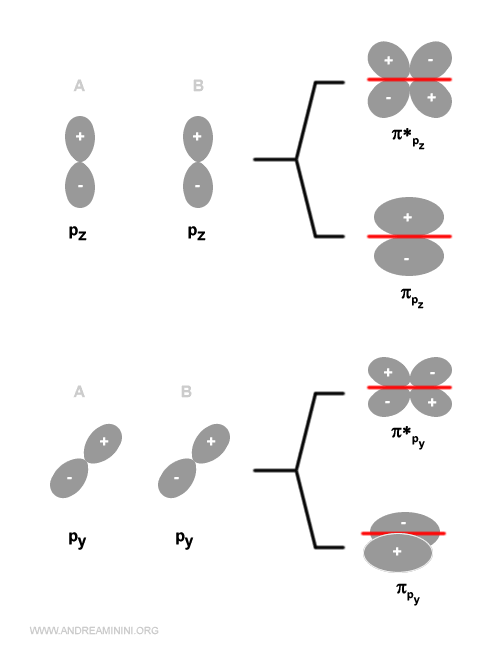
Gli orbitali di tipo pi greco
Gli orbitali di tipo py o pz generano, invece, un orbitale molecolare di tipo p greco (π) perché la densità elettronica è concentrata sopra e sotto l'asse internucleare.
Un esempio pratico
La molecola di ossigeno O2 è composta da due atomi di ossigeno.
La configurazione elettronica superficiale dell'ossigeno è 2s2 2p4. Quindi, ci sono sei elettroni di valenza per atomo.
Gli elettroni dei due atomi si dispongono negli orbitali molecolari con il livello di energia più basso disponibile.
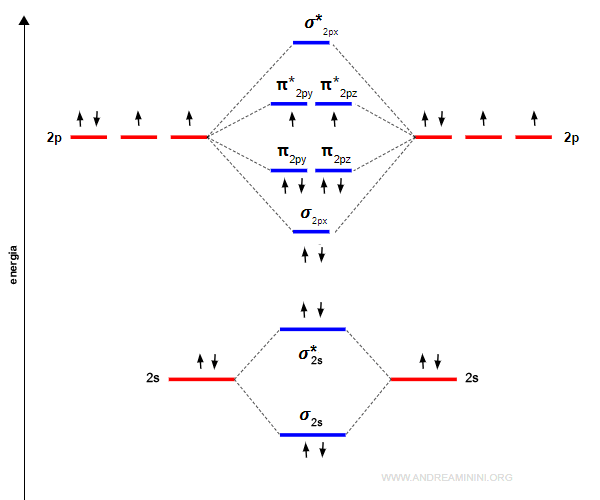
L'ordine di legame è maggiore di zero (ol=2). Pertanto, la molecola è stabile.
E così via.
