Ossiacidi
Cosa sono gli ossiacidi
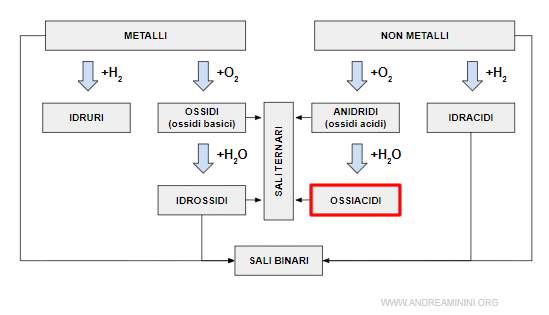
Gli ossiacidi (acidi ternari o acidi ossigenati) sono composti ternari formati dall'idrogeno, da un non metallo e dall'ossigeno.
Sono ottenuti per reazione tra una anidride e l'acqua.
Nella formula si scrive prima l'idrogeno, poi il non metallo e, infine, l'ossigeno.
$$ H \: [non \: metallo] \: O $$
Se si forma un solo ossiacido è denominato acido seguito dal nome del non metallo con il suffisso -ico.
acido [non metallo]-ico
Il nome del composto è preceduto dal prefisso mono- (facoltativo), di-, tri-, ecc. a seconda del numero di atomi dell'ossigeno.
Come gli altri acidi (idracidi) anche gli ossiacidi hanno la proprietà di reagire con l'acqua rendendo acida la sostanza acquosa, perché libera ioni di idrogeno H+.
Negli ossiacidi l'ossigeno si lega sia all'elemento non metallico che all'idrogeno.
Esempio
Il composto ClOH è formato da un atomo di cloro, di ossigeno e di idrogeno.
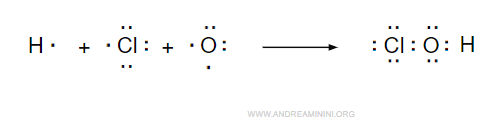
La configurazione superficiale del cloro è 3s2 3p5, quindi gli manca un elettrone per completare l'ottetto.
La configurazione superficiale dell'ossigeno è 2s2 2p4, quindi gli mancano due elettroni per completare l'ottetto.
La configurazione superficiale dell'idrogeno è 1s1, quindi gli manca un elettrone per completare il duetto.
Quindi, l'unico modo per legare i tre atomi è tramite un legame covalente O-H e un altro legame covalente tra l'ossigeno e l'elemento non metallico.
Un esempio pratico
Un esempio di acido ternario è l'acido clorico.
$$ HClO_3 $$
Nella nomenclatura IUPAC il composto della formula precedente è detto acido triossoclorico (V).
Dove V è la notazione di Stock ovvero il numero di ossidazione del non metallo.
La nomenclatura tradizionale
Nella nomenclatura tradizionale se si formano due ossiacidi si usano i suffissi -oso e -ico in base al numero di ossidazione del non metallo.
Il suffisso -oso è associato al non metallo con n.o. inferiore.
acido [non metallo] -oso
acido [non metallo] -ico
Se si formano quattro ossiacidi, invece, si usano anche i prefissi ipo- e per-
acido ipo-[non metallo]-oso
acido [non metallo]-oso
acido [non metallo]-ico
acido per-[non metallo]-ico
Esempio 1
L'acido triossosolforico (acido solforoso) $$ SO_2 + H_2O \rightarrow H_2SO_3 $$
Esempio 2
L'acido tetraossosolforico (acido solforico) $$ SO_3 + H_2O \rightarrow H_2SO_4 $$
Esempio 3
Altri esempi sono l'acido perclorico (HClO4), l'acido clorico (HClO3), l'acido cloroso (HClO2), l'acido ipocloroso (HClO).
I sali degli ossiacidi
Gli ossiacidi reagiscono con le basi formando dei sali detti sali degli ossiacidi.
I sali di ossiacidi si ottengono sostituendo gli atomi di idrogeno con gli atomi di un metallo.
Sono detti
- Sali neutri
se la sostituzione è completa - Sali acidi (o idrogenosali)
se la sostituzione è parziale
Nella nomenclatura IUPAC i sali neutri sono denominati sostituendo il termine "acido" da cui derivano con "sale" e il suffisso -ico con -ato, seguiti dal nome del metallo.
[non metallo]-ato di [metallo]
I sali acidi, invece, hanno anche il prefisso idrogeno- (o diidrogeno-, ecc.) prima del non metallo a seconda del numero di atomi di idrogeno presenti nel composto.
[di/tri/]-idrogeno-[non metallo]-ato di [metallo]
Se il metallo ha più numeri di ossidazione, si aggiunge il n.o. tra parentesi tonde secondo la notazione di Stock.
La nomenclatura tradizionale
Nella nomenclatura tradizionale si sostituisce dall'acido da cui deriva il suffisso -oso in -ito e -ico in -ato al nome del non metallo.
Gli eventuali prefissi ipo- e pre- del non metallo restano inalternati.
idrogeno-[non metallo]-ito di [metallo]
idrogeno-[non metallo]-ato di [metallo]
Se il metallo ha due numeri di ossidazione si aggiunge al nome del metallo il suffisso -oso a quello più basso e -ico a quello più alto.
Un esempio pratico
Questa formula indica il sale idrogenocarbonato di sodio
$$ NaHCO_3 (V) $$
Dove il numero romano tra parentesi indica il numero di ossidazione secondo la notazione di Stock.
E così via.
