La legge delle proporzioni multiple di Dalton
Se due elementi chimici si combinano tra loro formando più composti, la massa di un elemento si combina con la massa dell'altro elemento secondo un rapporto tra numeri interi.
Il fisico e chimico inglese John Dalton si accorse che gli elementi chimici differenti si combinano tra loro nei composti rispettando delle proporzioni/rapporti della massa espressi sempre con numeri interi.
Osservando questo fenomeno Dalton dedusse che la materia era composta da unità elementari indivisibili, ossia dagli atomi.
La legge delle proporzioni multiple è alla base della teoria atomica di Dalton.
Nota. Insieme alla legge della conservazione della massa di Lavoisier e alla legge delle proporzioni definite di Proust, la legge delle proporzioni multiple di Dalton è una delle leggi fondamentali della chimica.
Un esempio pratico
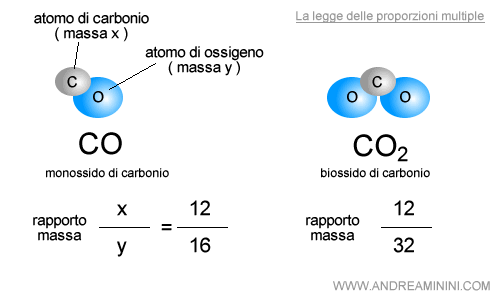
Gli elementi chimici del carbonio (C) e dell'ossigeno (O) si combinano insieme creando due composti:
- l'ossido di carbonio ( CO )
- il biossido di carbonio ( CO2 )
Nell'ossido di carbonio ( CO ) il rapporto tra la massa del carbonio e dell'ossigeno è uguale al rapporto 12/16.
Nel biossido di carbonio ( CO2 ) invece il rapporto è pari a 12/32.
Il rapporto di massa 12/32 è un multiplo del rapporto 12/16.
In questo caso è il doppio (k=2).
$$ \frac{12}{16 \cdot 2} = \frac{12}{32} $$
Pertanto, tutti i composti formati dal carbonio e dall'ossigeno rispettano una proporzione multipla
$$ \frac{12}{16 \cdot k} $$
Esempio 2
Studio i due composti di carbonio e ossigeno da un altro punto di vista.
Misuro la percentuale di carbonio e ossigeno in 100 grammi di ossido di carbonio (CO) e di anidride carbonica (CO2).
| Composto | Carbonio (%) | Ossigeno (%) |
|---|---|---|
| Ossido di carbonio | 42,86% | 57,14% |
| Anidride Carbonica | 27,27% | 72,73% |
Nota. Nell'ossido di carbonio (CO) ci sono 42,86% di carbonio e 57,14% di ossigeno. Nell'anidride carbonica (CO2) invece ci sono 27,27% di carbonio e il 72.73% di ossigeno.
Prendo come riferimento un grammo (massa) di carbonio.
Usando le percentuali che già conosco, calcolo quanti grammi (massa) di ossigeno si legano a un grammo di carbonio nei due composti.
Nell'ossido di carbonio (CO) la massa dell'ossigeno che si lega a un grammo di carbonio è
$$ m_O = \frac{1 \: g}{0,4686} - 1 = 1,3333 g $$
Nell'anidride carbonica (CO2) la massa dell'ossigeno che si lega a un grammo di carbonio è
$$ m_O = \frac{1 \: g}{0,2727} - 1 = 2,666 g $$
Aggiungo in tabella le misure sulle masse
| Composto | Carbonio (%) | Ossigeno (%) | Massa C (g) | Massa O (g) |
|---|---|---|---|---|
| Ossido di carbonio | 42,86% | 57,14% | 1,000 | 1,333 |
| Anidride Carbonica | 27,27% | 72,73% | 1,000 | 2,666 |
Il rapporto tra la massa di ossigeno che si lega a un grammo di carbonio nei composti CO e CO2 è un numero intero.
$$ \frac{2,666}{1,333} = 2 $$
Nota. Lo stesso risultato si ottiene analizzando qualsiasi composto chimico. Il rapporto tra gli elementi è sempre un numero intero.
Esempio 3
L'azoto (N) e l'ossigeno (O) formano diversi composti.
- N2O
- NO
- N2O3
- NO2
- N2O5
La massa dell'azoto e dell'ossigeno nei vari composti espressa in grammi è
| composti N e O | N | O |
|---|---|---|
| N2O | 28 gr | 16 gr |
| NO | 14 gr | 16 gr |
| N2O3 | 28 gr | 48 gr |
| NO2 | 14 gr | 32 gr |
| N2O5 | 28 gr | 80 gr |
Normalizzo la tabella dei composti esprimendo la stessa quantità di azoto (14) e adeguando quella dell'ossigeno.
| composti N e O | N | O |
|---|---|---|
| N2O | 28:2 | 16:2 |
| NO | 14 | 16 |
| N2O3 | 28:2 | 48:2 |
| NO2 | 14 | 32 |
| N2O5 | 28:2 | 80:2 |
Dopo aver svolto i calcoli la tabella diventa
| composti N e O | N | O |
|---|---|---|
| N2O | 14 | 8 |
| NO | 14 | 16 |
| N2O3 | 14 | 24 |
| NO2 | 14 | 32 |
| N2O5 | 14 | 40 |
Quest'ultima tabella mette ben in evidenza la proporzione multipla tra una quantità fissa di azoto e una quantità variabile di ossigeno.
La quantità di ossigeno che reagisce con la quantità fissa di azoto è
$$ 8 \: , \: 16 \: , \: 24 \: , \: 32 \: , \: 40 $$
Pertanto, il rapporto tra la massa di azoto e di ossigeno nei composti è
$$ \frac{14}{8} \: , \: \frac{14}{16} \: , \: \frac{14}{24} \: , \: \frac{14}{32} \: , \: \frac{14}{40} $$
I rapporti seguono una proporzione multipla per numeri interi k=1,2,3,4,5
$$ \frac{14}{8 \cdot k} $$
E così via.
