Massa
Cos'è la massa
La massa è la capacità di un corpo di opporsi alle variazioni del proprio stato di quiete o di moto rettilineo uniforme.
Questa breve definizione rende l'idea del concetto di massa in fisica e chimica.
Detto in altri termini la massa è la misura dell'inerzia di un corpo.
In fisica la massa è una delle grandezze fondamentali e la sua unità di misura è il kilogrammo (kg). Nelle formule viene normalmente indicata con la lettera $ m $ minuscola. Ad esempio, la forza $ F=m·a $ è definita come il prodotto tra la massa (m) e l'accelerazione (a). Nell'analisi dimensionale, infine, per indicare la massa viene utilizzata la lettera [M] maiuscola.
Un esempio pratico
Quando calcio una palla di gomma, questa si sposta per decine di metri.
Se calcio una palla di marmo con la stessa forza, non si sposta di un millimetro... probabilmente sono io a spostarmi all'ospedale.

Questo accade perché la resistenza opposta dalla palla di gomma alla variazione del suo stato di quiete è minima.
Viceversa, quella della palla di gomma è molto alta.
Quindi, la massa della palla di gomma è notevolmente più bassa rispetto alla palla di marmo.
L'unità di misura della massa
La massa è una delle grandezze fondamentali della fisica.
L'unità di misura della massa nel Sistema Internazionale (SI) è il kilogrammo (kg).
La storia del kilogrammo si sviluppa in tre fasi principali:
- Nel 1795, durante la rivoluzione francese, il kilogrammo viene definito come la massa di un litro d’acqua pura a 4 °C. Tuttavia, questo metodo si rivela poco pratico.
- Nel 1889 viene creato un campione materiale, un cilindro di platino-iridio, e conservato presso l'Ufficio Internazionale dei Pesi e delle Misure a Sèvres in Francia. Altre copie ufficiali vengono distribuite negli altri paesi per uniformare le misure a livello globale. Questo prototipo resta la definizione internazionale del kilogrammo per oltre 130 anni. Tuttavia, anche questo materiale è soggetto a lievissime variazioni di massa.
- Nel 2019 il kilogrammo viene ridefinito in termini di una costante fondamentale della fisica, la costante di Planck (h). In questo modo si elimina la dipendenza da un oggetto fisico e si basa la definizione su grandezze universali e immutabili, garantendo maggiore precisione e stabilità.
La differenza tra massa e peso
La massa non va confusa con il peso.
Il peso è la forza con cui un corpo viene attratto al centro della Terra per effetto della forza gravitazionale.
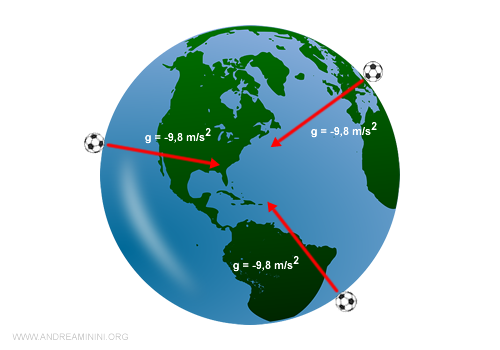
Quindi, il peso è una grandezza vettoriale. Devo considerare il suo modulo, direzione e verso. Per questa ragione spesso si parla più propriamente di forza-peso.
Viceversa, la massa è una grandezza scalare, ossia è soltanto un valore numerico.
Esempio. Il peso della palla di marmo cambia se lo misuro sulla Terra o sulla Luna perché la forza gravitazionale è diversa. Viceversa, la massa della palla di marmo è sempre la stessa, sia sulla Terra che sulla Luna. Se dessi un calcio alla palla di marmo sulla Luna mi farei comunque male.
In conclusione, il peso è proporzionale alla massa e la proporzione cambia a seconda della forza di gravità.
La massa è, invece, una grandezza indipendente dalla forza di gravità.
Come si misura la massa degli atomi
La massa assoluta degli elementi chimici varia da 10-22 e 10-24 grammi.
Per evitare di lavorare con valori così piccoli, la comunità scientifica preferì usare la massa relativa basata su una scala di pesi atomici in cui l'idrogeno (H) era pari a 1.
Il primo a usare i pesi atomici relativi anziché il peso assoluto fu Dalton. Scelse come riferimento l'atomo più leggero degli elementi ossia l'idrogeno.
Esempio. L'idrogeno ha peso atomico pari a MH=1. L'ossigeno ha peso atomico pari a MO=16 perché la sua massa è sedici volte quella dell'idrogeno. Il carbonio ha peso atomico pari a MC=12 perché la sua massa è dodici volte quella dell'idrogeno. E via dicendo.
Successivamente venne scelto di sostituire il valore di riferimento della scala con l'ossigeno (O), perché in natura quasi tutti gli elementi chimici formano dei composti binari con l'ossigeno.
In questo modo era possibile misurare direttamente le combinazioni delle masse degli elementi rispetto all'ossigeno.
Nota. In questa nuova scala l'idrogeno aveva un peso atomico pari a 1,008.
C'era però un problema pratico. L'ossigeno ha tre isotopi naturali:
$$ O_8^{16} \: , \: O_8^{17} \: , \: O_8^{18} \: , \:$$
In alcuni testi di chimica veniva preso come riferimento l'ossigeno-16, mentre in altri la media ponderata dei tre isotopi dell'ossigeno. Questo creò delle ambiguità.
Per stabilire una misura standard, nel 1961 venne scelto come riferimento 1/12 della massa del carbonio-12.
In questo modo nacque l'unità di massa atomica (uma) pari a
$$ 1 \: uma = 1,6606389 \cdot 10^{-24} g $$
E' la misura usata oggi per misurare la massa degli atomi.
La massa inerziale
La massa inerziale misura la resistenza al movimento di un corpo.
A parità di condizioni, un corpo dotato di maggiore massa oppone una maggiore resistenza allo spostamento.
La massa inerziale viene ben definita dalla fisica classica, in particolar modo dalla legge del moto di Newton:
$$ F = m \cdot a $$
Tanto maggiore è la massa (m) del corpo, tanto maggiore è la forza (F) necessaria per far compiere al corpo una determinata accelerazione (a).
La massa relativistica
Nella fisica classica la massa si considera una grandezza costante.
In realtà, nella teoria della relatività ristretta Einstein dimostrò che la massa è strettamente collegata alla velocità del corpo.
Per distinguere i due concetti si parla di massa e di massa relativistica (o massa relativa).
La massa relativa di un corpo è tanto più alta, quanto più la velocità (v) del corpo si avvicina alla velocità della luce (c).
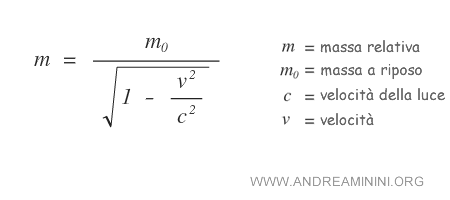
Dove m è la massa relativistica mentre m0 è la massa del corpo in condizioni di quiete.
Per velocità prossime alla velocità della luce v≅c il denominatore della formula tende a zero, quindi la massa tende a infinito.
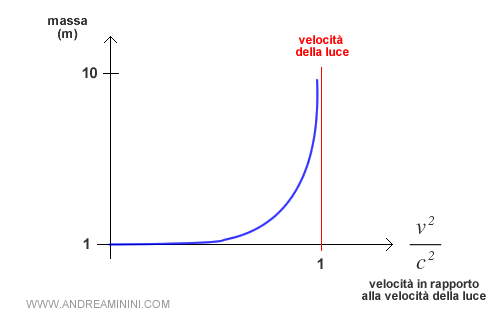
Viceversa, per velocità molto basse v→0 il denominatore della formula tende a uno. In questo caso la massa tende a essere costante m=m0.
Nota. Nella nostra realtà quotidiana i corpi si muovono a velocità molto più basse rispetto alla velocità della luce. Quindi, per semplicità si considera la massa come una grandezza costante m=m0 nello studio di molti fenomeni fisici.
E così via.
