Teoria VSEPR
La teoria VSEPR (Valence Shell Electron Pair Repulsion) permette di studiare la geometria di una molecola composta da più di due atomi sulla base della repulsione elettrostatica delle coppie di elettroni nello strato di valenza.
Secondo la teoria, i doppietti di elettroni (condivisi e non condivisi) si dispongono intorno a un atomo centrale in direzioni tali da minimizzare la repulsione tra gli elettroni ovvero nel modo più lontano possibile l'uno dagli altri.
Nota. Gli elettroni hanno tutti carica negativa. Quindi, avendo la stessa carica elettrostatica si rispingono tra loro
Le direzioni degli orbitali formano degli angoli di legame caratteristici della molecola.
Pertanto, posso risalire alla forma di una molecola tramite il numero delle coppie di elettroni presenti nello strato di valenza dell'atomo centrale.
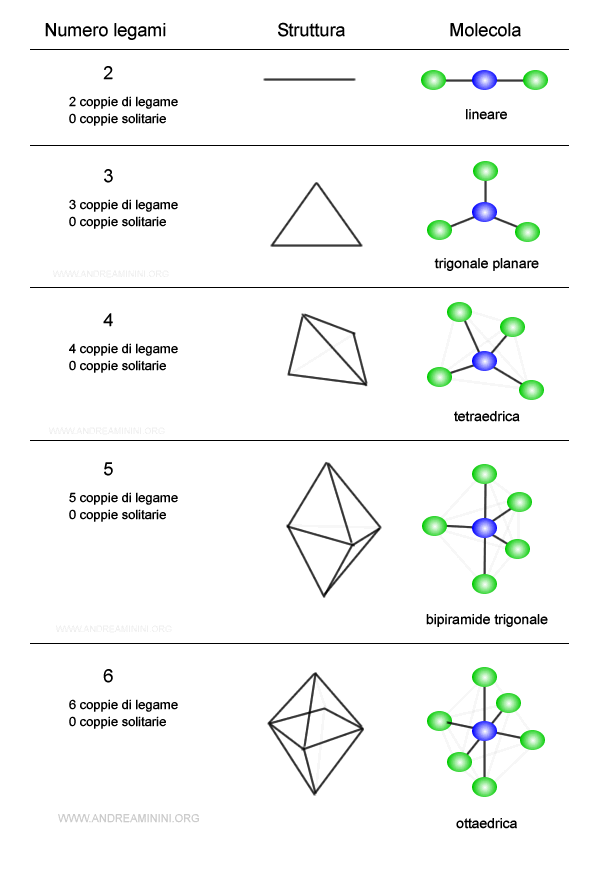
La struttura della molecola può comunque essere influenzata anche dal numero delle coppie solitarie e quello delle coppie di legame.
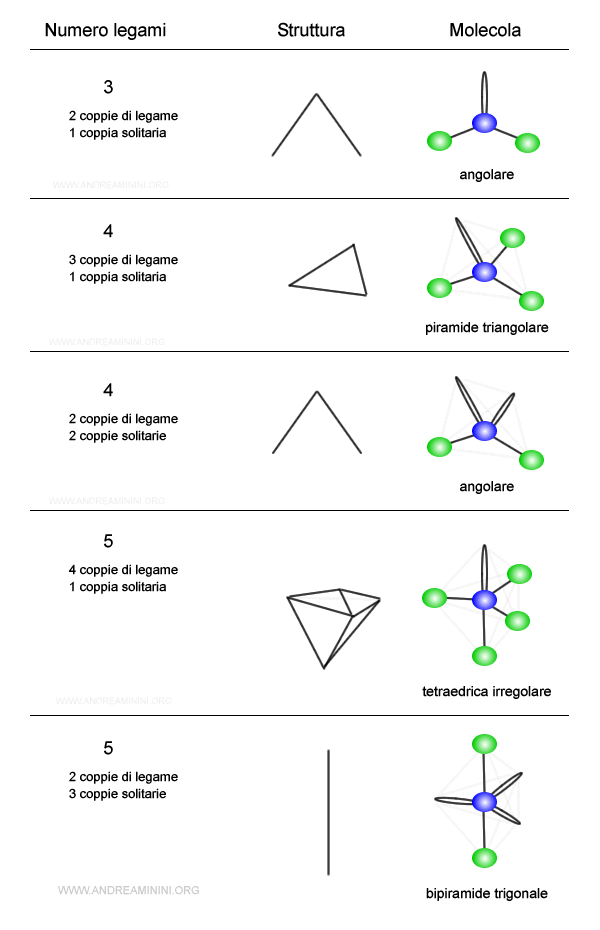
In presenza di coppie solitarie la molecola cambia la forma della struttura e gli angoli di legame.
Esempio. La struttura trigonale composta da tre coppie di legame diventa una struttura angolare quando ci sono due coppie di legame e una coppia solitaria.
Quando l'atomo centrale ha coppie di legame con atomi uguali, gli angoli di legame coincidono con quelli dei poligoni regolari.
Quando la struttura si distorce?
Gli angoli di legame subiscono delle variazioni se l'atomo centrale ha coppie di legame con atomi di elementi chimici diversi o in presenza di coppie solitarie.
In questi casi la struttura molecolare è più o meno distorta.
- Le coppie solitarie
Gli elettroni delle coppie di legame si trovano tra due nuclei atomici. Quindi, la nuvola elettronica è condivisa nello spazio tra due nuclei atomici. Gli elettroni delle coppie solitarie, invece, orbitano intorno a un solo atomo. Pertanto, la nuvola elettronica è concentrata in una regione molto più vicina al nucleo di un solo atomo. Essendo più concentrate intorno a un atomo, gli elettroni delle coppie solitarie hanno una forza di repulsione maggiore nei confronti delle altre coppie elettroniche. Questo distorce la forma della molecola.Esempio. La molecola d'acqua H2O è composta da due coppie di legame e due coppie solitarie. La struttura tetragonale diventa angolare. Tuttavia, essendo le coppie solitarie più repulsive delle coppie di legame, l'angolo di legame si riduce a 104°. Nella struttura tetragonale regolare è invece 109°.
- Legami con atomi diversi
Quando l'atomo centrale forma legami con atomi uguali, questi ultimi hanno la stessa elettronegatività. Viceversa, quando sono diversi anche l'elettronegatività è differente. La differenza di elettronegatività distorce la struttura molecolare.Esempio. La molecola del cloruro di metile CH3Cl ha una struttura tetraedrica con gli angoli di legame H-C-H di 110° e angoli di legame Cl-C-H di 108°. Questo accade perché l'atomo di cloro (Cl) è più elettronegativo rispetto al carbonio (C) e attira con più forza le coppie di elettroni Cl-C. Di conseguenza si riduce la repulsione delle coppie nei legami C-H e C-Cl.
Anche l'elettronegatività dell'atomo centrale modifica la distanza tra le coppie di legame. Quando è più bassa rispetto agli atomi legati, aumenta la distanza tra le coppie di legame e si riduce la repulsione reciproca.
Esempi pratici
Esempio 1
Nella molecola BeCl2 l'atomo di berillio (Be) è legato a due atomi di cloro (Cl).
La configurazione elettronica del berillio è 2s2 mentre quella di un atomo di cloro è 3s2 3p5.
Quindi si formano due legami covalenti (due coppie di legame) tra l'atomo di berillio (atomo centrale) e gli atomi di cloro.
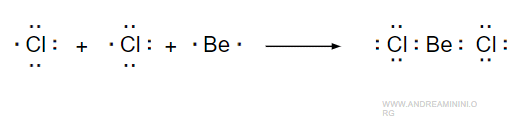
Non ci sono coppie solitarie nell'atomo di berillio.
Qual è la forma della molecola?
Le due coppie di elettroni tendono a spostarsi più lontano possibile l'una dall'altra.
Pertanto, si spostano in direzioni opposte con angoli di legame di 180°.
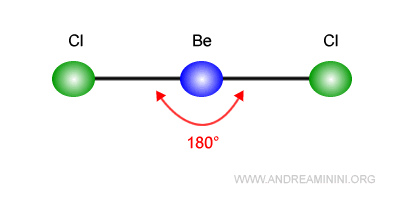
Quindi, la struttura della molecola BeCl2 assume una forma lineare.
Esempio 2
Nella molecola del tricloruro di boro BCl3 l'atomo di boro (B) è legato a tre atomi di cloro (Cl).
La configurazione elettronica del boro è 2s2 2p1 mentre quella di un atomo di cloro è 3s2 3p5.
Si formano tre legami covalenti (tre coppie di legame) tra l'atomo di boro e gli atomi di cloro.

Non ci sono coppie solitarie nell'atomo di boro.
Qual è la forma della molecola?
Le tre coppie di elettroni si spostano in direzioni diverse, più lontano possibile l'una dall'altra, formando una figura trigonale planare con angoli di legame di 120°.
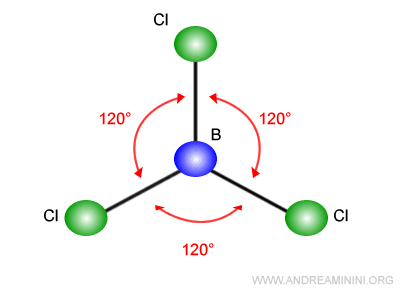
In questo caso la struttura della molecola BCl3 ha una forma triangolare simmetrica.
Legami multipli e legami sigma
Nella teoria VSEPR, per determinare la geometria della molecola, i legami multipli (es. doppi, tripli, ecc.) intorno all'atomo centrale devono essere considerati come legami semplici.
Secondo la definizione più rigorosa della teoria VSEPR, le coppie di valenza sigma si dispongono nello spazio in modo tale da minimizzare la repulsione elettrostatica delle coppie di elettroni.
Quindi, soltanto i legami sigma vanno analizzati.
Spiegazione. Poiché una coppia sigma si trova in ogni legame chimico (semplice o multiplo) mentre le coppie pi-greco si trovano soltanto nei legami multipli, per determinare la geometria di una molecola devo contare ogni legame multiplo come un legame semplice. Perché i legami pi greco non si considerano? In un legame multiplo i legami pi-greco sono legami coassiali con il legame sigma, quindi nello spazio hanno la stessa direzione del legame sigma. Pertanto, non influenzano sulla forma della molecola.
La presenza dei legami multipli può comunque modificare gli angoli di legame della struttura, perché l'angolo di legame nei legami multipli è più ampio che nei legami semplici.
Questo accade perché il legame multiplo ha una nuvola elettronica più grande rispetto a un legame semplice.
Esempio
La molecola F2CO ha un doppio legame (O=C) e due legami semplici (C-F).
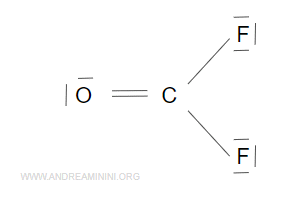
Il doppio legame (O=C) lo conto come un unico legame.
Quindi, la molecola è composta da tre legami sigma e secondo la teoria VSEPR ha una struttura triangolare.
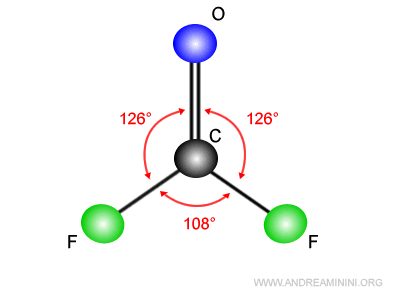
Nota. Poiché la nuvola elettronica del doppio legame è più grande rispetto ai legami semplici, gli angoli di legame F-C-O (con doppio legame O=C) sono di circa 126°, più ampi rispetto all'angolo di legame F-C-F di 108°.
E così via.
