Processi reversibili e irreversibili in termodinamica
In termodinamica una trasformazione è reversibile se può essere invertita tramite la variazione infinitesimale di un parametro (es. temperatura, pressione, volume, ecc.). Viceversa, è detta irreversibile.
Nei processi reversibili una piccola variazione di una variabile di stato causa una variazione infintesimale di altre variabili di stato del sistema.
E' una successione tra infiniti stati di equilibrio in cui le grandezze variano in modo continuo.
Esempio. Un piccolo aumento della pressione incrementa di poco il volume di un gas (compressione). Viceversa, una piccola diminuzione della pressione diminuisce di poco il volume di un gas (espansione). Il processo è reversibile.
Nei processi irreversibili, invece, il processo non può essere invertito.
Generalmente i processi spontanei sono irreversibili.
Le reazioni chimiche in equilibrio, invece, sono processi reversibili.
Il lavoro nei processi reversibili e irreversibili
A parità di trasformazione di stato un processo reversibile compie un lavoro L maggiore rispetto a un processo irreversibile. $$ L_{rev} > L_{irrev} $$
L'effetto sul calore e il lavoro è diverso a seconda se il processo è reversibile o irreversibile.
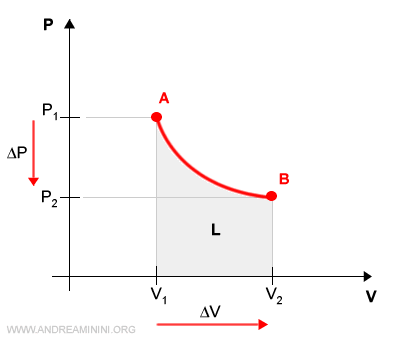
A] Il processo reversibile
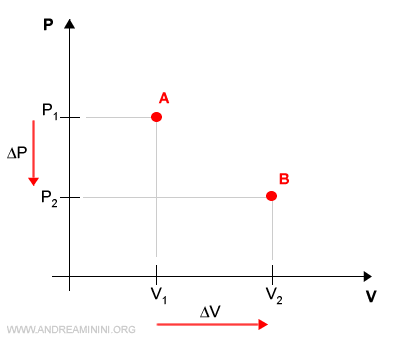
In un processo reversibile un gas aumenta il proprio volume ΔV a parità di temperatura (isoterma).
$$ \Delta V = V_2 - V_1 $$
Per effetto dell'espansione del volume la pressione del gas si riduce ΔP da P1 a P2.
$$ \Delta P = P_2 - P_1 $$
Il sistema termodinamico passa dallo stato di equilibrio iniziale A allo stato di equilibrio finale B.
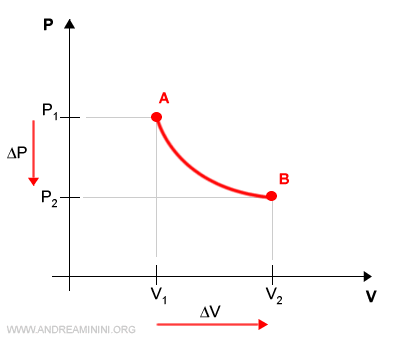
Essendo un processo reversibile, posso suddividere la variazione di volume ΔV in variazioni infinitesimali di volume dV, una per ogni punto tra V1 e V2.
Ogni punto della curva è uno stato di equilibrio intermedio a seguito di una piccola variazione del volume (dV).
L'espansione infinitesima del volume dV genera un lavoro infinitesimo dL pari alla pressione esterna Pe per la variazione infinitesimale del volume dV.
$$ dL = P_e \cdot dV $$
La pressione interna differisce di un infinitesimo rispetto a quella esterna.
$$ P - dP = P_e $$
Nota. In base all'equazione di stato generale dei gas la pressione è inversamente proporzionale al volume. $$ P = \frac{nRT}{V} $$ Se il recipiente è più grande, la stessa quantità di gas si espande in uno spazio più grande. Quindi, la pressione interna si riduce di dP.
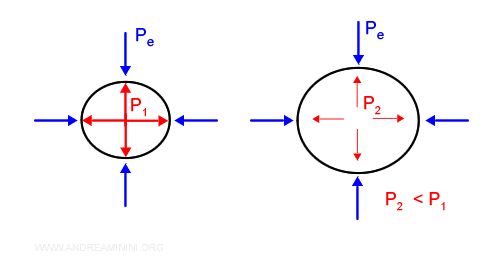
Quindi, la pressione interna è uguale alla pressione esterna + dp. $$ P = P_e+dp $$
Essendo una variazione infinitesima posso assumere che la pressione interna (P) è molto simile alla pressione esterna (Pe).
$$ P ≅ P_e $$
Pertanto, posso riscrivere la formula del lavoro infinitesimale in questo modo
$$ dL = P \cdot dV $$
Dal punto di vista grafico ogni lavoro infinitesimale è una retta che congiunge un punto dell'asse delle ascisse a un punto della curva.
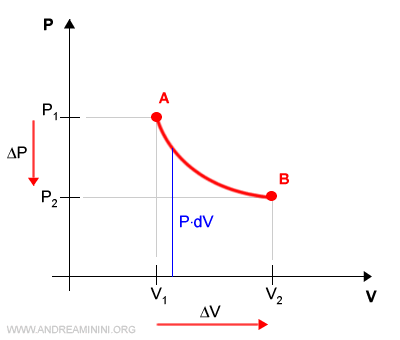
Il lavoro complessivo L è uguale alla somma di tutte i lavori infinitesimi dL nell'intervallo tra V1 a V2.
$$ L = \int_{V_1}^{V_2} P \: \: dV $$
Dal punto di vista grafico il lavoro è la superficie compresa tra il grafico e l'asse delle ascisse.
B] Il processo irreversibile
In un processo irreversibile riduco bruscamente la pressione del gas a parità di temperatura (isoterma) da P1 a P2 senza variare il volume V.
Poi, mantenendo costante la pressione a P2, espando il volume da V1 a V2.
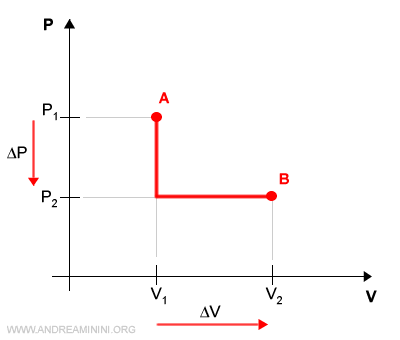
Essendo una variazione irreversibile, non ci sono stati di equilibrio intermedi tra lo stato A e lo stato B.
In questo caso il lavoro complessivo L è l'area P2(V2-V1) tra il grafico e l'asse delle ascisse.
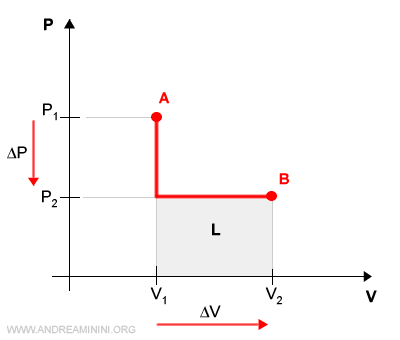
Quindi, a parità di stato iniziale (A) e finale (B) il processo irreversibile eroga una quantità di lavoro inferiore rispetto al processo reversibile.
Il calore nei processi reversibili e irreversibili
La quantità di calore scambiata da un sistema termodinamico in una trasformazione di stato reversibile è maggiore rispetto alla stessa trasformazione di stato irreversibile. $$ Q_{rev} > Q_{irrev} $$
La dimostrazione
So che a parità di condizioni un processo reversibile eroga una quantità di lavoro maggiore rispetto allo stesso processo irreversibile.
$$ L_{rev} > L_{irrev} $$
Il lavoro (L) è una forma di energia insieme al calore (Q).
Per il primo principio della termodinamica vale la variazione dell'energia interna (ΔE) di un sistema è uguale al calore meno il lavoro.
$$ \Delta E = Q - L $$
Quindi, il calore è uguale alla somma del lavoro e la variazione dell'energia interna.
$$ Q = \Delta E + L $$
Distinguo la formula del calore nel caso di un processo reversibile e di un processo irreversibile.
$$ Q_{rev} = \Delta E + L_{rev} $$
$$ Q_{irrev} = \Delta E + L_{irrev} $$
Poi sottraggo membro a membro le due equazioni
$$ Q_{rev} - Q_{irrev} = \Delta E + L_{rev} - (\Delta E + L_{irrev} ) $$
$$ Q_{rev} - Q_{irrev} = \Delta E + L_{rev} - \Delta E - L_{irrev} $$
$$ Q_{rev} - Q_{irrev} = L_{rev} - L_{irrev} $$
E' noto che un processo reversibile eroga più lavoro rispetto allo stesso processo irreversibile
$$ L_{rev} > L_{irrev} $$
Pertanto, anche al membro di sinistra dell'equazione il calore di un processo reversibile è maggiore rispetto allo stesso processo irreversibile.
$$ Q_{rev} > Q_{irrev} $$
In questo modo ho dimostrato che a parità di condizioni il calore scambiato da un processo reversibile è maggiore rispetto al processo irreversibile.
Nota. Generalmente i processi spontanei sono anche processi irreversibili. Quindi, la differenza di calore scambiato da un processo nella forma reversibile e irreversibile è una misura della tendenza alla spontaneità del processo.
E così via.
