Entalpia di reazione
Cos'è l'entalpia di reazione
L'entalpia di reazione misura il calore assorbito o rilasciato dalle sostanze in una reazione chimica, detto calore di reazione.
Si richiama al significato fisico dell'entalpia nella termodinamica ossia "portare il calore dentro".
La spiegazione
Una reazione chimica è composta da sostanze reagenti e prodotti.
$$ A + B \rightarrow C+ D $$
Le sostanze reagenti (A+B) hanno un determinato livello di entalpia H1, mentre i prodotti (C+D) hanno un'entalpia pari a H2.
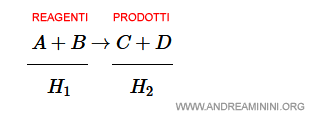
Pertanto, la reazione chimica causa una variazione di entalpia (ΔH) dai reagenti ai prodotti.
$$ ΔH = H_2 - H_1 $$
A questo punto faccio in modo che la reazione chimica avvenga in condizioni di pressione e volume costante, ad esempio in una bomba di calore.
Dalla termodinamica so che
- A pressione costante la variazione di entalpia (ΔH) è uguale al calore scambiato dal sistema (QP). $$ ΔH = Q $$
- A volume costante il calore scambiato dal sistema (QV) è uguale alla variazione dell'energia interna del sistema (ΔE). $$ ΔE = Q $$
Nota. Per un approfondimento leggere gli appunti sulle trasformazioni a pressione costante e a volume costante.
Pertanto, misurando il calore assorbito o rilasciato dalla reazione chimica tramite un calorimetro, posso misurare la variazione dell'entalpia della reazione (ΔH).
- Se ΔH>0 la reazione è endotermica
La variazione dell'entalpia ΔH>0 indica che l'entalpia nei prodotti è aumentata, quindi il sistema ha assorbito calore dall'esterno. La reazione è endotermica. - Se ΔH<0 la reazione è esotermica
La variazione dell'entalpia ΔH<0 indica che l'entalpia nei prodotti è diminuita rispetto ai reagenti, quindi il sistema ha ceduto calore all'esterno. La reazione è esotermica.
Nota. Il termine entalpia dal greco significa "portare il calore dentro". Quindi, se ΔH>0 il calore interno del sistema è aumentato. E viceversa.
La reazione endotermica
Una reazione chimica è una reazione endotermica se assorbe calore. Questo accade quando la variazione di entalpia è positiva. $$ ΔH>0 $$
Sapendo che in condizioni di pressione costante la variazione di entalpia è uguale al calore scambiato
$$ ΔH = Q $$
Dove il calore scambiato (Q) può essere visto come il calore dei prodotti (Q2) meno il calore dei reagenti (Q1).
$$ Q = Q_2 - Q_1 $$
Se Q>0 il calore Q2 dei prodotti della reazione è maggiore rispetto al calore dei reagenti Q1, vuol dire che la materia ha assorbito calore.
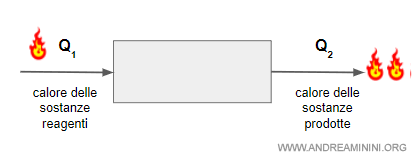
Per il primo principio della termodinamica l'energia non si crea, né si distrugge ma si trasforma.
Quindi, per equilibrare la trasformazione di stato del sistema occorre aggiungere una quantità di calore in entrata.
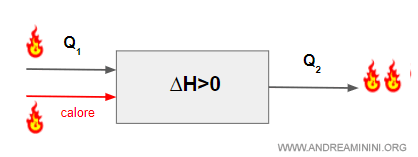
Al lato sinistro della reazione chimica devo aggiungere una quantità di calore pari a Q=Q2-Q1
$$ A + B + calore \rightarrow C+ D $$
La reazione chimica assorbe calore dall'esterno ossia è una reazione endotermica.
Essendo il calore scambiato un valore positivo (Q>0) anche la variazione di entalpia è positiva (ΔH>0).
$$ ΔH = Q > 0 $$
In conclusione, se la variazione di entalpia è un numero maggiore di zero (ΔH>0) la reazione chimica è endotermica.
La reazione esotermica
Una reazione chimica è una reazione esotermica se cede calore all'esterno. Questo accade quando la variazione di entalpia è negativa. $$ ΔH<0 $$
Sapendo che in condizioni di pressione costante la variazione di entalpia è uguale al calore scambiato
$$ ΔH = Q $$
Il calore scambiato Q può essere visto come il calore dei prodotti (Q2) meno il calore dei reagenti (Q1).
$$ Q = Q_2 - Q_1 $$
Se Q<0 il calore Q2 dei prodotti della reazione è minore rispetto al calore dei reagenti Q1, vuol dire che la materia ha perso calore.

Per il primo principio della termodinamica l'energia non si crea, né si distrugge ma si trasforma.
Quindi, per equilibrare la trasformazione di stato occorre aggiungere una quantità di calore in uscita.
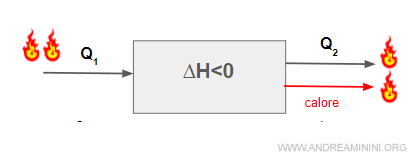
Al lato destro della reazione chimica devo aggiungere una quantità di calore pari a Q
$$ A + B \rightarrow C+ D + calore $$
La reazione chimica cede calore dall'esterno ossia è una reazione esotermica.
Essendo il calore scambiato un valore negativo (Q<0) anche la variazione di entalpia è negativa (ΔH<0).
$$ ΔH = Q < 0 $$
In conclusione, se la variazione di entalpia è un numero minore di zero (ΔH<0) la reazione chimica è esotermica.
E così via.
