Energia libera
Cos'è l'energia libera
L'energia libera (G) è una funzione di stato del sistema termodinamico determinata dalla differenza tra l'entalpia (H) e il prodotto dell'entropia (S) per la temperatura (T) durante un passaggio di stato a pressione e temperatura costante. $$ G = H - TS $$
E' anche detta energia libera di Gibbs, dal nome del chimico statunitense J.W. Gibbs.
L'energia libera è una funzione di stato in quanto è determinata da altre funzioni di stato del sistema termodinamico.
Se viene misurata a pressione (1 atm) e temperatura (25°C) costanti è detta energia libera standard.
A cosa serve?
L'energia libera mi permette di capire se una trasformazione è spontanea usando soltanto le funzioni di stato del sistema termodinamico, senza considerare l'ambiente esterno.
Una trasformazione è
- reversibile (stato di equilibrio)
se nel passaggio di stato la variazione di energia libera è nulla $$ ΔG=0 $$ - irreversibile (spontanea)
se nel passaggio di stato la variazione di energia libera è negativa $$ ΔG<0 $$ - non spontanea
se nel passaggio di stato la variazione di energia libera è positiva $$ ΔG>0 $$ In questo caso è spontanea la trasformazione inversa.
Nota. Si tratta di un vantaggio molto importante. Per verificare se un processo è spontaneo potrei usare anche l'entropia totale (S). $$ \Delta S_{totale} = \Delta S_{sistema} + \Delta S_{ambiente} $$ In questo caso però devo analizzare l'universo come un sistema isolato e analizzare anche le variazioni dell'entropia dell'ambiente circostante al sistema ossia ΔSambiente. Il che è abbastanza complesso da fare. L'energia libera, invece, mi permette di farlo analizzando soltanto le variabili di stato che si trovano dentro il sistema termodinamico senza considerare l'ambiente esterno.
La spiegazione e dimostrazione
La variazione infinitesima dell'energia libera è la sua derivata prima dG rispetto alla temperatura assoluta (T).
$$ dG = dH - d(ST) $$
Calcolo la derivata del prodotto d(ST)
$$ dG = dH - (SdT + TdS) $$
$$ dG = dH - SdT - TdS $$
La trasformazione avviene a temperatura costante, la derivata della temperatura è nulla (dT=0).
$$ dG = dH - TdS $$
La trasformazione si verifica anche a pressione costante.
Quando la pressione è costante la variazione di entalpia coincide con il calore scambiato dal sistema Q ossia dH=dQ.
$$ dG = dQ - TdS $$
Nota. Sapendo che la variazione infinitesima di entropia è uguale alla variazione infinitesima del calore in una trasformazione reversibile divisa per la temperatura $$ dS = \frac{dQ_{rev}}{T} $$ deduco che TdS è uguale alla variazione infinitesima di calore in un processo reversibile $$ TdS = dQ_{rev} $$
$$ dG = dQ - dQ_{rev} $$
A questo punto è facile calcolare la spontaneità o meno della trasformazione.
- Se il processo è reversibile la variazione del calore dQ=dQrev. Quindi, la variazione dell'energia libera dG è pari a zero. $$ dG = dQ - dQ_{rev} = 0 $$
- Se il processo è irreversibile la variazione del calore dQ<dQrev è sempre inferiore rispetto a un processo reversibile. Quindi, la variazione dell'energia libera dG è minore di zero. $$ dG = dQ - dQ_{rev} < 0 $$
Pertanto, considerando le variazioni finite tra due stati (iniziale e finale) la trasformazione è
- reversibile (in equilibrio) se ΔG=0
- irreversibile (spontanea) se ΔG<0
- non spontanea se ΔG>0
(è spontanea la trasformazione inversa)
Nota. La disequazione tra variazione finite è detta equazione di Gibbs-Helmholtz $$ \Delta G = \Delta H - T \Delta S $$
Una dimostrazione alternativa
Posso dimostrare l'energia libera anche a partire dalla variazione di entropia in un sistema isolato.
$$ \Delta S_{totale} = \Delta S_{sistema} + \Delta S_{ambiente} \ge 0$$
Sapendo che la variazione di entropia dell'ambiente ΔSambiente è uguale al calore scambiato dall'ambiente con il sistema diviso per la temperatura assoluta T
$$ \Delta S_{ambiente} = \frac{dQ}{T} $$
A pressione costante il calore scambiato dall'ambiente è uguale alla variazione di entalpia del sistema ma con segno opposto poiché adesso il punto di riferimento è l'ambiente
$$ \Delta S_{ambiente} = \frac{dQ}{T} = - \frac{\Delta H}{T} $$
Sostituisco ΔSambiente nella prima equazione
$$ \Delta S_{totale} = \Delta S_{sistema} + \Delta S_{ambiente} \ge 0 $$
$$ \Delta S_{totale} = \Delta S_{sistema} - \frac{\Delta H}{T} \ge 0 $$
Poi moltiplico entrambi i membri per la temperatura T
$$ T \Delta S_{totale} = T \Delta S_{sistema} - T \frac{\Delta H}{T} \ge 0$$
$$ T \Delta S_{totale} = T \Delta S_{sistema} - \Delta H \ge 0 $$
Cambio il segno di tutti i termini e della diseguaglianza.
$$ -T \Delta S_{totale} = -T \Delta S_{sistema} + \Delta H \le 0 $$
Ponendo ΔG = -TΔStotale diventa
$$ \Delta G = -T \Delta S_{sistema} + \Delta H \le 0 $$
ossia
$$ \Delta G = \Delta H - T \Delta S_{sistema} \le 0 $$
L'equazione di Gibbs
Se la trasformazione avviene a temperatura e pressione costante, la variazione di energia libera ΔG è uguale alla differenza tra la variazione di entalpia ΔH e la variazione di entropia ΔS moltiplicata per la temperatura T. $$ \Delta G = \Delta H - T \Delta S $$
Il segno di ΔG permette di capire la spontaneità di una trasformazione fisica o chimica.
- Il processo con ΔH<0 e ΔS>0 è sicuramente spontaneo perché ΔG<0.
- Il processo con ΔH>0 e ΔS<0 è sicuramente non spontaneo perché ΔG>0.
- Se ΔH=TΔS allora il processo è in equilibrio perchè ΔG=0.
- Negli altri casi la spontaneità del processo dipende dai pesi relativi dei due termini.
In alcuni casi basta conoscere il segno delle variazioni di entalpia ed entropia per capire se un processo è spontaneo o no.
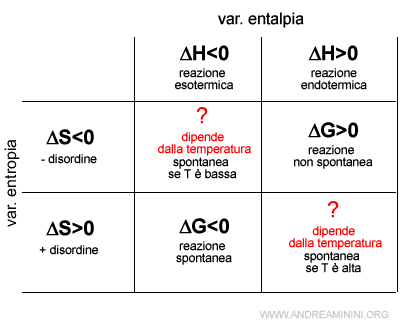
In altri casi, invece, bisogna calcolare a quali temperature il processo è spontaneo.
Un esempio pratico
Esempio 1
A quale temperatura il processo di evaporazione dell'acqua è spontaneo?
$$ H_2O(l) \rightarrow H_2O(g) $$
Per ipotesi considero una condizione ambientale a pressione costante pari a 1 atm.
L'entalpia di evaporazione di una mole d'acqua è ΔH=40,67 kJ per mole mentre l'entropia di evaporazione è ΔS=109 JK per mole.
Nota. Si tratta di una reazione endotermica ΔH>0 in cui aumenta l'entropia ΔS>0 nel passaggio di stato. Quindi non posso desumere subito qual è la variazione dell'energia libera. Dipende dalla temperatura T. Per conoscere la spontaneità o meno della trasformazione devo calcolare l'equazione di Gibbs.
Per prima cosa calcolo la condizione di equilibrio dell'equazione di Gibbs, quella in cui la variazione di energia libera è nulla.
$$ ΔG = ΔH - T \cdot ΔS = 0 $$
Metto in evidenza T
$$ T = \frac{ΔH}{ΔS} $$
Poi sostituisco i valori noti del problema
$$ T = \frac{40,67 \: kJ \cdot mol^{-1}}{109 \: J \cdot mol^{-1} \cdot K^{-1}} = \frac{40670}{109 \: K^{-1}} = 373 \: K $$
Alla temperatura assoluta T=373 K (ossia 100°C) il processo è in equilibrio.
Questo vuol dire che
- Se T>373 K il processo è spontaneo
Per temperature superiori a 373 K la variazione di energia libera ΔG<0 è negativa e il processo di evaporazione dell'acqua è spontaneo. - Se T<373 K il processo non è spontaneo
Per temperature inferiori a 373 K la variazione di energia libera ΔG>0 è positiva e il processo di evaporazione dell'acqua non è spontaneo. In questo caso è spontaneo il processo inverso ossia la condensazione.
Nota. Grazie alla termodinamica sono giunto a questi risultati senza analizzare gli aspetti molecolari delle sostanze reagenti/prodotte o il tempo.
Esempio 2
Devo verificare se questa reazione chimica è spontanea
$$ 2NO(g) + O_2(g) \rightarrow 2NO_2 $$
Per prima cosa calcolo la variazione dell'entalpia standard di reazione.
$$ ΔH° = 2 ΔH° (NO_2) - [ 2 ΔH°(NO) + ΔH°(O_2) ] $$
Sapendo che ΔH°(O2(g))=0 kJ/mol, ΔH°(NO2(g))=33,72 kJ/mol e ΔH°(NO(g))=90,37 kJ/mol.
$$ ΔH° = 2 \cdot 33,72 \: kJ/mol - [ 2 \cdot 90,37 \: kJ/mol + 0] $$
$$ ΔH° = -113,3 \: kJ/mol$$
Poi calcolo la variazione dell'entropia standard
$$ ΔS° = 2 ΔS° (NO_2) - [ 2 ΔS°(NO) + ΔS°(O_2) ] $$
Sapendo che ΔS°(O2(g))=205,02 J/K·mol, ΔS°(NO2(g))=240,45 J/K·mol e ΔH°(NO(g))=210,65 J/K·mol.
$$ ΔS° = 2 \cdot 240,45 \: J/K·mol - [ 2 \cdot 210,65 \: J/K·mol + 205,02 \: J/K·mol ] $$
$$ ΔS° = -145,36 \: J/K·mol $$
Ora verifico se a 25°C (T=298 K) la reazione è spontanea tramite l'equazione di Gibbs
$$ \Delta G° = \Delta H° - T \Delta S° $$
$$ \Delta G° = -113,3 \: kJ/mol - 298 K \cdot ( -145,36 J/K·mol ) $$
$$ \Delta G° = -113,3 \: kJ/mol - 298 \cdot ( -145,36 J/mol ) $$
$$ \Delta G° = -113,3 \: kJ/mol + 43317,28 J/mol ) $$
$$ \Delta G° = -113,3 \: kJ/mol + 43,31 kJ/mol ) $$
$$ \Delta G° = -69,99 kJ/mol ) $$
Poiché la variazione di energia libera è negativa ΔG°<0, la reazione chimica è spontanea.
E così via.
