Regola delle fasi
La regola delle fasi (o regola di Gibbs) calcola la varianza (v) di un sistema considerando il numero dei componenti indipendenti (c) e il numero delle fasi (f).
La varianza indica il numero delle variabili indipendenti (es. pressione, temperatura, concentrazione) che possono essere modificati senza alterare il numero delle fasi del sistema.
Se nel sistema variano sia la temperatura che la pressione la varianza è
$$ v = c+2-f $$
Dove il numero 2 indica le due variabili della pressione e della temperatura.
Nei sistemi in cui varia soltanto la pressione (isobari) o la temperatura (isotermi), la varianza è
$$ v = C+1-f $$
Nota. I sistemi con più componenti possono avere più fasi in equilibrio contemporaneamente. Solo le miscele gassose formano sempre un'unica fase. I liquidi, invece, possono essere insolubili tra loro e formare diverse fasi liquide. Anche i solidi possono formare fasi solide diverse se hanno una struttura cristallina molto diversa.
Un esempio pratico
Nell'acqua è presente un solo componente indipendente (c=1).
$$ H_2O $$
Guardando il diagramma delle fasi dell'acqua, nei punti di confine (riga verde) le fasi in equilibrio sono due (f=2). Nel punto triplo C invece sono tre (f=3). In tutti gli altri punti c'è una sola fase (f=1).
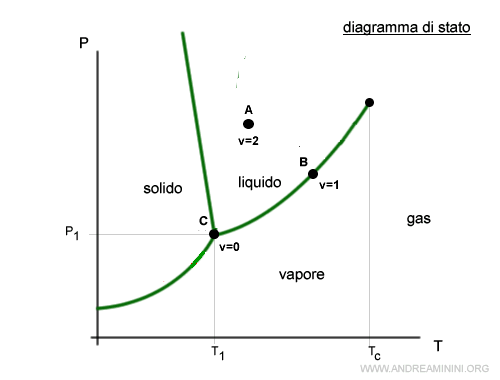
Calcolo la varianza nel punto A dove f=1 tramite la regola delle fasi.
$$ v = c +2 - f = 1 + 2 - 1 = 2$$
La varianza v=2 vuol dire che nel punto A il sistema è bivariante, ossia posso modificare di poco sia la pressione che la temperatura senza alterare il numero delle fasi presenti nel sistema (f=1).
Nel punto B, invece, ci sono due fasi in equilibrio (f=2) e la varianza è uguale a
$$ v = c +2 - f = 1 + 2 - 2 = 1 $$
La varianza v=1 vuol dire che il sistema è monovariante.
Se modifico la temperatura (o pressione) esiste un solo valore della pressione (o temperatura) in grado di mantenere l'equilibrio del sistema senza alterare il numero delle fasi.
Nel punto C, infine, ci sono tre fasi in equilibrio (f=3) e la varianza è uguale a
$$ v = c +2 - f = 1 + 2 - 3 = 0 $$
La varianza v=0 vuol dire che qualsiasi variazione della pressione, della temperatura o della composizione, altera il numero delle fasi del sistema.
Esempio 2
Nel caso delle reazioni chimiche in equilibrio bisogna considerare il numero delle specie chimiche e delle reazioni.
$$ CaCO_3{(s)} \rightleftharpoons CaO_{(s)} + CO_{2(g)} $$
Questa reazione chimica ha tre componenti e una sola reazione.
Il numero dei componenti indipendenti lo ottengo sottraendo il numero delle reazioni dal numero dei componenti.
$$ c=3-1 = 2 $$
Quindi, ci sono due componenti indipendenti (c=2).
Le fasi della reazione sono tre (f=3) perché, oltre a una fase gassosa, ci sono due fasi solide sono distinte tra loro.
A questo punto, uso la regola delle fasi per calcolare la varianza del sistema
$$ v = c+2-f = 2+2-3 = 1 $$
La varianza v=1 vuol dire che il sistema è monovariante, ossia variando la temperatura esiste un solo valore della pressione in grado di mantenere l'equilibrio e il numero delle fasi correnti (f=3) del sistema.
Allo stesso modo variando la pressione esiste un solo valore della temperatura in grado di mantenere l'equilibrio e il numero delle fasi correnti (f=3) del sistema.
E così via.
