Il reticolo cristallino
Cos'è un reticolo cristallino
Un reticolo cristallino è un aggregato di ioni positivi e negativi legati tra loro dalle forze elettrostatiche.
Si forma nei composti ionici allo stato solido detti anche solidi ionici o cristalli ionici.
Nei reticoli cristallini non si sono molecole ma un vasto numero di ioni positivi e negativi legati tra loro dalle forze elettrostatiche,.
Come si forma un reticolo
Quando due atomi si legano tra loro con un legame ionico, un atomo trasferisce all'altro un elettrone.
L'atomo che perde l'elettrone si trasforma in uno ione positivo mentre quello che lo acquisisce in uno ione negativo.
La vicinanza con gli altri ioni spinge gli atomi legati a disporsi in modo regolare formando un reticolo.
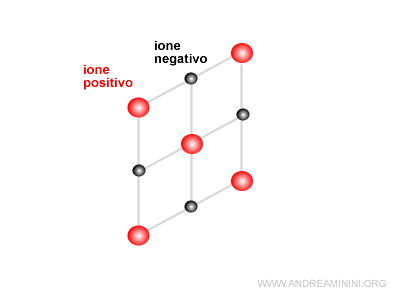
Le forze attrattive e repulsive spingono gli atomi legati a disporsi in modo tale da eguagliare nello spazio le distanze con le cariche dello stesso segno e quelle con di pari carica.
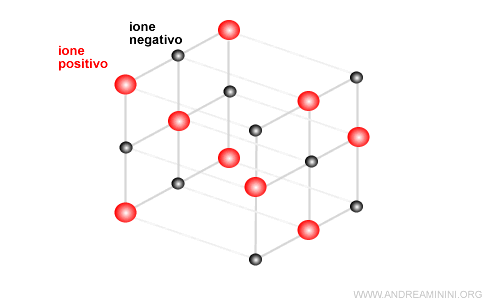
Si forma così un reticolo cristallino di ioni positivi e negativi che può assumere diverse forme.
Nel caso del cloruro di sodio (sale da cucina) è una struttura cubica.
L'energia reticolare
Cos'è l'energia reticolare
L'energia reticolare di un composto è l'energia che viene rilasciata quando si forma un reticolo (solido ionico) a partire dagli ioni isolati oppure, in modo equivalente, l'energia necessaria per scomporre un reticolo cristallino.
L'energia reticolare determina la stabilità del reticolo cristallino.
Se è molto alta, il reticolo è molto stabile. E viceversa.
Come misurare l'energia reticolare
Per calcolare l'energia reticolare si ricorre si ricorre a un calcolo teorico
$$ E_r = -M \frac{Nz^2}{4πε_0d} $$
Dove
- N è il numero degli ioni positivi (o degli ioni negativi)
- M è la costante di Madelung
- d è la distanza tra gli ioni
- ε0 è una costante pari a 8,85·10-12C2 m-1·J-1 è una costante
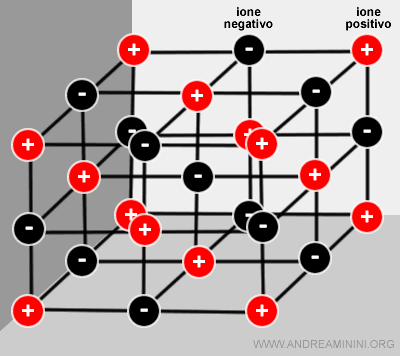
Nota. La costante di Madelung è sempre maggiore di 1, varia a secondo il tipo di struttura cristallina e del numero di coordinazione (es. nel cloruro di sodio è pari a 1,748). Dove il numero di coordinazione è il numero di ioni di segno opposto che circondano uno ione (es. nel cloruro di sodio è pari a 6:6)
Esempio
In un reticolo cristallino di cloruro di sodio (NaCl) ogni ione è circondato da 6 ioni di segno opposto a una distanza d.

Il contributo all'energia di reticolo è
$$ E_r = - 6 \cdot \frac{z^2}{4πε_0d} $$
Ogni ione ha intorno anche 12 ioni dello stesso segno alla distanza d·√2

Il contributo all'energia di reticolo è
$$ E_r = + 12 \cdot \frac{z^2}{4πε_0d \cdot \sqrt{2} } $$
Altri 8 ioni di segno opposto si trovano alla distanza d·√3 e via dicendo.
Complessivamente l'energia di reticolo è
$$ E_r = - 6 \cdot \frac{z^2}{4πε_0d} + 12 \cdot \frac{z^2}{4πε_0d \cdot \sqrt{2} } - 8 \cdot \frac{z^2}{4πε_0d \cdot \sqrt{3}} \: ... $$
I termini numerici moltiplicano lo stesso rapporto che posso mettere in evidenza
$$ E_r = \frac{z^2}{4πε_0d} \cdot ( - 6 + \frac{12}{ \sqrt{2}} - \frac{8}{ \sqrt{3}} \: ... ) $$
Per semplicità scrivo il rapporto con la lettera M e lo chiamo costante di Madelung.
$$ M = \frac{z^2}{4πε_0d} $$
Quindi riscrivo la formula
$$ E_r = M \cdot ( - 6 + \frac{12}{ \sqrt{2}} - \frac{8}{ \sqrt{3}} \: ... ) $$
o alternativamente
$$ E_r = -M \cdot ( 6 - \frac{12}{ \sqrt{2}}+ \frac{8}{ \sqrt{3}} \: ... ) $$
Un metodo alternativo
A partire dal bilancio di energia del legame ionico
$$ E_p = ΔE_1 +ΔE_2 + ΔE_3 + ΔE_4 + E_r $$
Conoscendo l'energia potenziale degli atomi legati e le variazioni di energia dovute alla sublimazione (ΔE1), alla dissociazione (ΔE2), alla ionizzazione (ΔE3), all'affinità elettronica (ΔE4), si può risalire per differenza dal bilancio di energia all'energia reticolare.
$$ E_r = E_p - (ΔE_1 +ΔE_2 + ΔE_3 + ΔE_4) $$
Esempio
Nel caso del cloruro di sodio sapendo che Ep=-415 kJ/mol, ΔE1=110, ΔE2=120, ΔE3=494, ΔE4=-349 posso calcolare per differenza l'energia del reticolo Er
$$ E_p = ΔE_1 + ΔE_2 + ΔE_3 + ΔE_4 + E_r $$
$$ -415 = 110 + 120 + 494 - 349 + E_r $$
$$ E_r = -415 - (110 + 120 + 494 - 349) kJ/mol $$
$$ E_r = 790 kJ/mol $$
Quindi, quando si conoscono i dati del bilancio di energia del legame ionico basta un semplice calcolo algebrico per ottenere l'energia reticolare.
E così via
