Legami sigma
In una molecola i legami σ (legami sigma) sono legami chimici tra gli elettroni di atomi diversi tramite la sovrapposizione degli orbitali s e/o px.
Nei legami σ la sovrapposizione degli orbitali avviene sull'asse che congiunge i due nuclei atomici.
Per questa ragione il legame sigma è detto legame "frontale" o "testa a testa".
Un esempio pratico
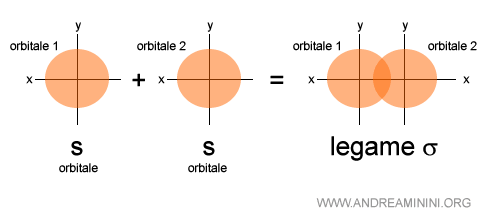
Esempio 1
Ecco un legame sigma tra orbitali di tipo s.
I due orbitali sono sovrapposti parzialmente in modo frontale ossia sullo stesso asse dei nuclei atomici.
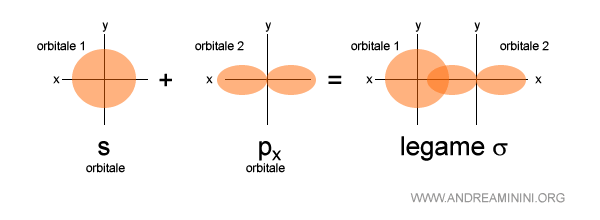
Esempio 2
Questo è invece un legame sigma tra un orbitale di tipo s e un orbitale di tipo p.
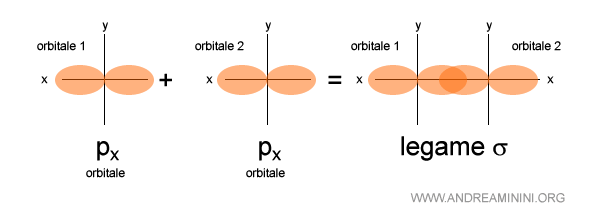
Esempio 3
Questo è un legame sigma tra due orbitali di tipo px.
Come i precedenti è sempre sullo stesso asse congiungente i nuclei atomici.
Le caratteristiche del legame sigma
Il legame sigma è più esteso del legame π (pi greco), quindi il legame σ è più forte del legame π.
E' il primo legame a formarsi. Se due atomi condividono una sola coppia di elettroni, questi formeranno un legame sigma.
Quindi, se tra gli atomi di una molecola c'è un solo legame semplice, è sicuramente un legame σ.
Nota. Se invece due atomi condividono due o più coppie di elettroni, la prima è un legame di tipo sigma mentre le altre sono legami di tipo π (legame pi greco).
Di conseguenza, in una molecola può esserci un solo legame sigma.
Gli orbitali ibridi
Quasi tutti i legami sigma sono composti da orbitali ibridi.
Questo accade perché gli orbitali ibridi del tipo sp hanno una maggiore capacità di sovrapposizione con gli altri orbitali.
Quindi, consentono legami multipli e sono più forti rispetto agli orbitali puri di tipo s o p.
E così via.
