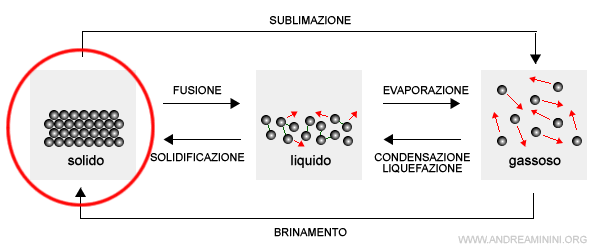
Curva di raffreddamento
La curva di raffreddamento si ottiene raffreddando una sostanza, a pressione costante, a partire da un'alta temperatura iniziale.
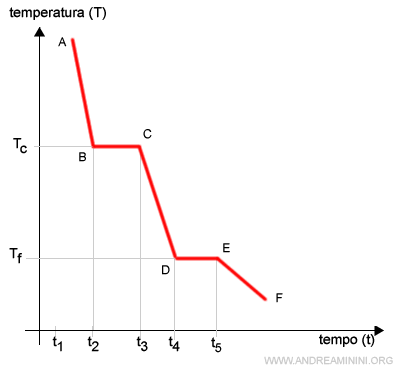
Nell'asse delle ascisse si misura il tempo (t) mentre nell'asse delle ordinate la temperatura (T).
L'asse delle ascisse misura indirettamente anche la quantità di calore sottratta al sistema a causa del raffreddamento.
La curva è caratterizzata da alcuni cambiamenti di pendenza dovuti allo stato di aggregazione (aeriforme, liquido, solido) delle particelle della materia.
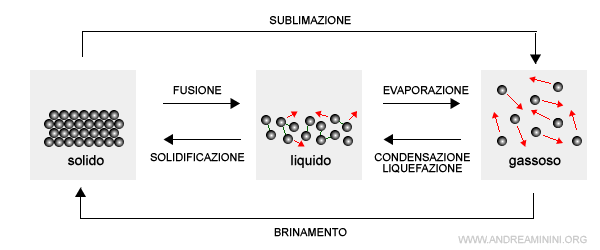
Durante la condensazione e la solidificazione la perdita di calore non riduce la temperatura della sostanza.
Nota. La condensazione è il passaggio di stato da aeriforme (vapore) a liquido mentre la solidificazione è il passaggio di stato da liquido a solido.
Come disegnare la curva di raffreddamento
Inizialmente la sostanza si trova allo stato aeriforme a temperature molto alte.
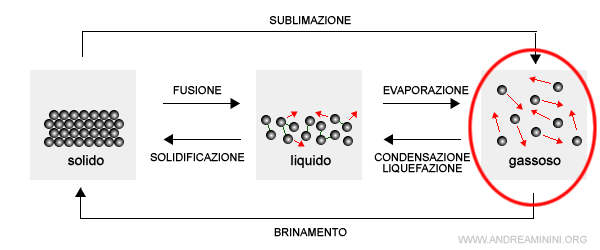
La perdita di calore della sostanza riduce l'energia cinetica delle molecole, il cui moto subisce un rallentamento.
La minore energia cinetica delle particelle causa la riduzione della temperatura nel tratto AB.
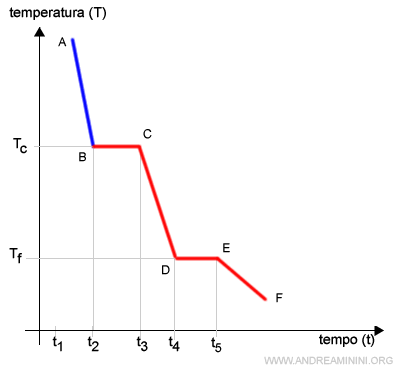
Nel tratto BC la velocità delle particelle è sufficientemente bassa per consentire la formazione di legami intermolecolari tra le particelle.
I legami intermolecolari trattengono temporaneamente alcune molecole vicine tra loro.
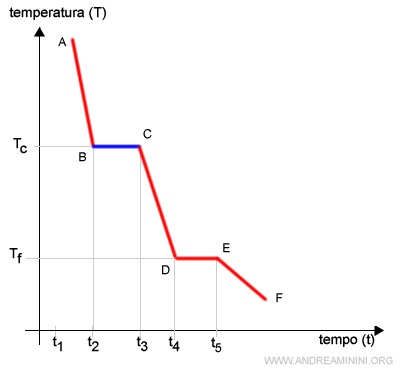
In questo tratto la perdita di calore non riduce l'energia cinetica bensì l'energia potenziale delle particelle.
Per questa ragione la temperatura si mantiene costante nel tempo.
Nota. Nel tratto BC comincia il fenomeno della condensazione, ossia il passaggio di stato della materia dalla fase aeriforme (vapore) alla fase liquida.
Nel tratto CD la sostanza si trova prevalentemente allo stato liquido.
La perdita di calore riduce la velocità (energia cinetica) delle molecole del liquido.
La minore velocità delle molecole causa la diminuzione della temperatura della sostanza.
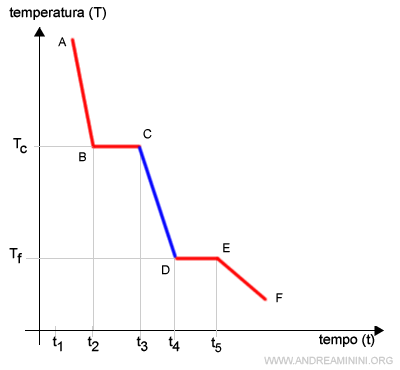
Quando la sostanza raggiunge la temperatura di solidificazione, le molecole formano dei legami stabili con le molecole vicine.
Nel tratto DE si verifica la solidificazione, ossia il passaggio della sostanza dalla fase liquida alla fase solida.
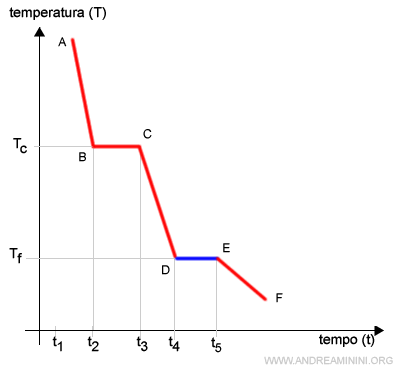
In questo tratto della curva di raffreddamento la perdita di calore non riduce l'energia cinetica delle molecole bensì l'energia potenziale delle molecole.
Nota. In un solido le molecole smettono di muoversi e mantengono una posizione fissa.
Nel successivo tratto EF la materia si trova allo stato solido.
Quindi, le molecole non si muovono e l'energia cinetica è nulla.
In questo tratto la perdita di calore riduce soltanto le vibrazioni delle molecole su se stesse.
La minore vibrazione delle molecole è la causa della diminuzione della temperatura nel tratto EF.
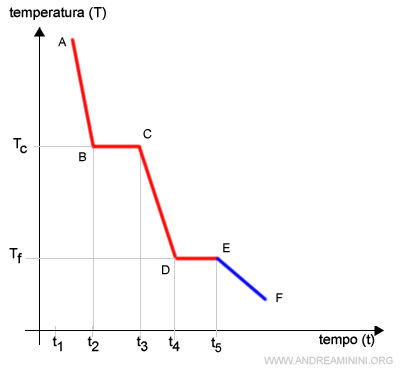
Con la perdita del calore la temperatura della sostanza continua a scendere fino allo zero assoluto su scala Kelvin, circa -273°C.
Allo zero assoluto le vibrazioni delle molecole cessano del tutto.
Non essendoci vibrazioni al di sotto, lo zero assoluto è la temperatura più bassa possibile in natura.
Nota. Nel caso dei solidi amorfi il tratto di solidifcazione DE è molto più breve perché le molecole non devono trovare una posizione in un reticolo ordinato, bensì si fermano nel punto in cui si trovano. Viceversa, nei solidi cristallini il tratto di solidificazione DE è molto più lungo nel tempo.
Il sottoraffreddamento
Quando la sostanza raggiunge la temperatura di solidificazione, la temperatura non diventa subito costante ma continua a scendere ancora per un breve tratto.
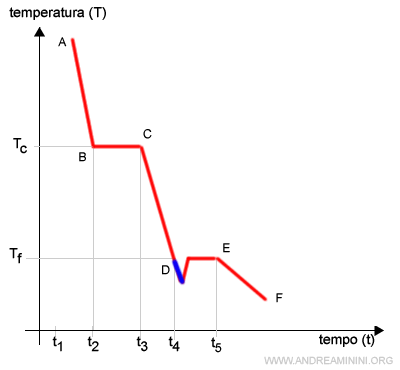
Questo fenomeno è detto sottoraffreddamento ed è dovuto alla formazione dei primi cristalli.
La nascita dei primi cristalli agevola la solidificazione delle altre molecole.
Il calore ceduto per formare i primi cristalli del reticolo viene riassorbito e la temperatura della sostanza torna alla temperatura di solidificazione.
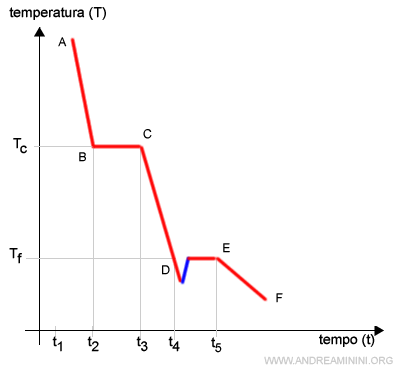
Nota. La temperatura di solidificazione e la temperatura di fusioni sono uguali. E' la stessa temperatura vista da due versi diversi (liquido->solido o solido->liquido). Per questa ragione il fenomeno del sottoraffreddamento è anche conosciuto come sovrafusione.
E così via.
