Secondo principio della termodinamica
Cosa dice la seconda legge della termodinamica
Ogni sistema tende spontaneamente verso lo stato di più probabile di massima entropia dove, in generale, l'energia disponibile è minima e il disordine è massimo.
Il secondo principio della termodinamica è spiegato con diversi enunciati equivalenti. I più usati sono i seguenti:
- il calore tende spontaneamente a spostarsi da un corpo caldo a un corpo freddo. Non accade il contrario. O perlomeno, non accade spontaneamente
- Non è possibile trasformare integralmente il calore in lavoro. Quindi, il calore non può essere convertito spontaneamente al 100% in lavoro.
Entrambi gli enunciati sono equivalenti e sottolineano "spontaneamente".
Esempio. In natura tutto tende spontaneamente verso un livello di energia più basso possibile. Ad esempio, in chimica due atomi si legano tra loro in una molecola a una particolare distanza (detta distanza di legame) per raggiungere un livello di energia potenziale più basso. La differenza di energia è detta energia di legame.
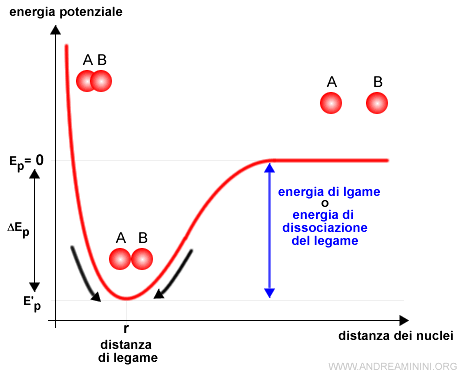
Per separare i due atomi occorre fornire alla molecola una quantità di energia pari o superiore all'energia di legame.
Qual è lo stato più probabile?
In generale, lo stato più probabile a cui tende spontaneamente un sistema è quello a minore energia.
Tuttavia, non si tratta di una regola generale perché la spontaneità di un processo dipende sia dalla tendenza a ridurre l'energia e sia dalla tendenza ad aumentare il grado di disordine.
A volte le due tendenze sono in conflitto.
Per questa ragione il secondo principio della termodinamica è strettamente legato al concetto fisico di entropia che misura il grado di disordine del sistema.
La differenza tra processi spontanei e non spontanei
Nella realtà quotidiana osserviamo processi spontanei e non.
- I processi spontanei
Un processo è spontaneo quando si verifica naturalmente senza dover assorbire energia all'esterno.
Esempio. Gran parte dei processi naturali sono spontanei. Il caldo fluisce verso il freddo, le molecole del gas tendono a occupare tutto lo spazio disponibile di un recipiente, ecc. In entrambi i casi il processo inverso non è invece spontaneo.
- Processi non spontanei
Un processo non è spontaneo quando richiede l'impiego di un'energia esterna o il compimento di un lavoro per realizzarsi. Non si verifica naturalmente.Esempio. La compressione di un gas o lo spostamento del freddo verso il caldo non sono processi spontanei. Per realizzarli è necessario aumentare l'energia disponibile del sistema.
Come capire se un processo è spontaneo
La variazione dell'entalpia non dà alcuna informazione sulla spontaneità o meno di un processo.
In genere le reazioni esotermiche, quelle che cedono calore all'esterno e causano una riduzione dell'entalpia del sistema (ΔH<0), sono processi spontanei.
Esempio. Un vaso su un balcone ha un elevata energia potenziale. Quando cade e si rompe al suolo, frantumandosi in modo disordinato in mille pezzi. Con la caduta perde la sua energia potenziale, cedendo l'energia interna sotto forma di calore ed energia cinetica. Quindi, l'entalpia si riduce (ΔH<0).
Tuttavia, non è una regola generale perché alcune reazioni esotermiche non sono spontanee.
Inoltre, in natura esistono anche reazioni endotermiche spontanee (ΔH>0).
Questo accade perché la spontaneità di un processo è determinata anche dal grado di disordine.
In natura i processi tendono naturalmente dall'ordine al disordine.
E' un'altro aspetto da non dimenticare.
Esempio. Se getto dei chicchi caffè per terra, questi si distribuiscono in modo disordinato sul pavimento. Pur non essendo impossibile, la probabilità che si distribuiscano in modo regolare è veramente molto bassa. Quindi, in natura lo stato di disordine ha maggiore probabilità di verificarsi rispetto allo stato di ordine. In base al secondo principio di termodinamica qualsiasi sistema tende allo stato più probabile, quello in cui il disordine è maggiore.

Quindi, anche una reazione endotermica può essere spontanea se aumenta il grado di disordine del sistema.
Esempio 1. Il sale è un composto ionico caratterizzato da una struttura cristallina molto ordinata. Quando il sale si scioglie nell'acqua assorbe energia (reazione endotermica) e passa a uno stato di maggiore disordine. Quindi, la dissoluzione del sale nell'acqua è un processo endotermico e spontaneo.
Esempio 2. A temperature superiori allo 0° la fusione del ghiaccio da solido a liquido è un processo spontaneo e endotermico perché il ghiaccio assorbe calore.
Considerando entrambi gli aspetti posso affermare che
- Le trasformazioni di stato spontanee di un sistema termodinamico sono determinate da due fattori
- La tendenza a raggiungere lo stato di minima energia
- La tendenza a assumere lo stato di massimo disordine
Generalmente in una sistema meccanico prevale il primo fattore (minima energia).
Nei processi fisici e chimici, invece, i due fattori possono essere concordi o contrastanti.
Nelle reazioni chimiche esotermiche spontanee sono concordi mentre nelle reazioni endotermiche spontanee sono contrastanti.
Se in una reazione endotermica l'aumento del grado di disordine prevale sull'incremento dell'energia disponibile, il processo è comunque spontaneo.
Esempio. L'espansione di un gas ideale è un processo spontaneo che si verifica anche senza variazioni di energia interna. Dopo l'espansione le molecole si distribuiscono in un volume più grande, quindi aumenta il disordine.
Allo stesso modo una reazione esotermica potrebbe non essere spontanea se il grado di disordine diminuisce e prevale sulla riduzione di energia disponibile.
Da cosa dipende il grado di disordine?
Il grado di disordine di un sistema termodinamico dipende dalla temperatura e dallo stato di aggregazione della materia.
- Il grado disordine aumenta al crescere della temperatura.
- Il grado disordine della materia allo stato gassoso è più alto rispetto allo stato liquido e solido.
- Il grado disordine della materia allo stato solido è il più basso.
Pertanto, se la reazione chimica causa la trasformazione della materia dallo stato solido allo stato liquido o gassoso, aumenta il grado di disordine del sistema.
Per misurare il grado di disordine del sistema termodinamico si usa una variabile di stato apposita detta entropia.
Come misurare la tendenza alla spontaneità di un processo
La tendenza di un processo a presentarsi spontaneamente, si può misurare tramite la differenza tra il calore scambiato dal processo quando è reversibile e irreversibile.
Generalmente le reazioni spontanee sono trasformazioni irreversibili.
Sapendo che, a parità di condizioni, un processo reversibile eroga più calore rispetto allo stesso processo irreversibile.
$$ Q_{rev} > Q_{irrev} $$
La differenza tra il calore del processo reversibile meno quello del calore irreversibile è una misura della spontaneità o meno del processo.
$$ Q_{rev} - Q_{irrev} $$
Nota. Uno stesso fenomeno può presentarsi in modo spontaneo o indotto da qualche azione. In questi casi è possibile misurare il suo grado di spontaneità.
L'entropia nei sistemi isolati
Se considero l'intero universo come un immenso sistema isolato, la seconda legge della termodinamica può essere scritta anche in questo modo:
La variazione totale di entropia ΔStot dell'universo è uguale a zero nelle trasformazioni reversibili $$ ΔS_{tot} = ΔS_{sistema} + ΔS_{ambiente} = 0 $$ è maggiore di zero nelle trasformazioni irreversibili (spontanei) $$ ΔS_{tot} = ΔS_{sistema} + ΔS_{ambiente} > 0 $$.
In questa definizione considero la variazione di entropia totale dell'universo come la somma della variazione di entropia del sistema e quella dell'ambiente che lo circonda.
Osservando la variazione di entropia totale (sistema + ambiente) si capisce se la trasformazione è spontanea oppure no.
- ΔSTot > 0
la trasformazione è spontanea - ΔSTot = 0
il sistema è in equilibrio - ΔSTot < 0
la trasformazione inversa è spontanea
La differenza tra prima e seconda legge della termodinamica
La prima e la seconda legge della termodinamica osservano aspetti diversi della realtà e si completano a vicenda.
- La prima legge della termodinamica non pone limite ai trasferimenti di energia. L'energia può trasformarsi da una forma all'altra. Non distingue tra processi reversibili e irreversibili. Quindi, non fornisce alcuna informazione sulla spontaneità dei processi fisici e chimici.
- La seconda legge della termodinamica, invece, osserva l'irreversibilità di alcuni fenomeni, perché in natura alcuni processi spontanei si svolgono in un'unica direzione. Quindi, pone un limite alla trasformazione dell'energia.
In un certo senso, la prima legge è ottimistica mentre la seconda è pessimistica.
E così via.
