La teoria delle collisioni
Secondo la teoria delle collisioni una reazione chimica si verifica quando le particelle dei reagenti (atomi, ioni, molecole) si urtano tra loro con un'energia cinetica e un'orientazione tale da vincere le forze repulsive elettrostatiche.
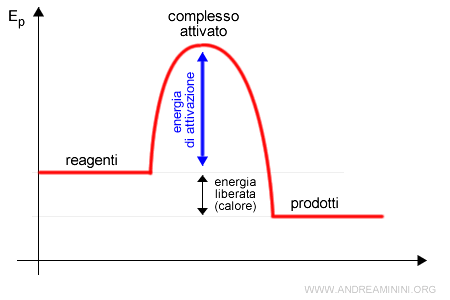
Quando l'energia cinetica è sufficientemente elevata, le nuvole elettroniche dei reagenti si compenetrano formando un insieme di elettroni instabile ad alta energia, detto complesso attivato.
L'energia necessaria per formare il complesso attivato è detta energia di attivazione.
Nota. Non tutte le particelle dei reagenti hanno una direzione, un verso e una velocità tali da oltrepassare l'energia di attivazione. Pertanto, per superare questa barriera è spesso necessario fornire calore ai reagenti, ossia riscaldarli, per aumentare l'energia cinetica delle particelle.
Nel complesso attivato gli elettroni formano dei nuovi legami tra gli atomi dando origine a una struttura chimica diversa rispetto a quella iniziale.
In questo modo, secondo la teoria delle collisioni si formano i prodotti a partire dai reagenti in una reazione chimica.
Ecco un esempio di reazione esotermica. Dove Ep è l'energia potenziale.
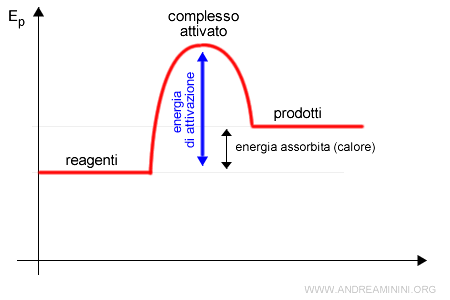
Un altro esempio di reazione chimica endotermica.
La teoria delle collisioni fornisce anche una spiegazione di cinetica chimica alla velocità di reazione.
Quanto più è bassa l'energia di attivazione per formare il complesso attivato, tanto più una reazione chimica si completa rapidamente.
Viceversa, se l'energia di attivazione è molto alta, la reazione chimica è più lenta.
Quali fattori influiscono sulla velocità di reazione
La velocità della reazione dipende dalla forza necessaria per rompere i legami chimici dei reagenti. Tanto maggiore è la forza del legame chimico, tanto più lenta è la reazione.
Altri fattori da considerare sono
- La temperatura
L'innalzamento della temperatura incrementa la velocità delle particelle (energie cinetica) aumentando la probabilità di ottenere degli urti efficaci. - La concentrazione
La velocità di reazione dipende anche dalla concentrazione delle particelle, quanto più sono concentrate in un'unità di volume, tanti più sono gli urti. - I catalizzatori
La presenza di catalizzatori tra i reagenti riduce l'energia di attivazione, aumentando la velocità della reazione. - Lo stato di suddivisione
La suddivisione dei reagenti rende più veloce la reazione perché la superficie di contatto è maggiore.
E così via.
