Soluzioni reali
Una soluzione è detta soluzione reale se si discosta dal comportamento di una soluzione ideale. E' anche detta soluzione non ideale.
Nel caso delle soluzioni reali la legge di Raoult necessita di una correzione.
$$ P_A=P*_A \cdot x_A \cdot γ_A $$
$$ P_B=P*_B \cdot x_B \cdot γ_B $$
Dove gamma (γ) è il coefficiente di attività, indica la distanza tra il comportamento della soluzione reale e ideale.
- Se gamma è uguale a 1, il comportamento della soluzione reale è uguale alla soluzione ideale.
- Se gamma è diverso da 1, la soluzione è reale. Quanto più gamma è lontano da 1, tanto più il comportamento della soluzione è non ideale ossia reale.
I coefficienti di attività variano per componente, soluzione e composizione. Quindi, sono estremamente variabili.
La differenza tra soluzione reale e ideale. Una soluzione ideale è caratterizzata da una variazione di entalpia della soluzione pari a zero. Il comportamento di una soluzione ideale è ben definito dalla legge di Raoult. In una soluzione reale, invece, la variazione di entalpia della soluzione può essere positiva o negativa.
Le soluzioni reali possono comunque essere considerate ideali quando sono molto diluite.
La differenza tra soluzioni ideali e reali
La principale differenza tra una soluzione ideale e reale è nella variazione di entalpia della soluzione.
- Le soluzioni ideali hanno una variazione di entalpia della soluzione nulla $$ \Delta H_{sol} = 0 $$
- Le soluzioni reali hanno una variazione di entalpia della soluzione non nulla $$ \Delta H_{sol} \ne 0 $$ La formazione di una soluzione reale è endotermica se ΔHsol>0, è esotermica se ΔHsol<0. La variazione di entalpia positiva o negativa genera tensioni di vapore diverse rispetto a una soluzione ideale.
Un esempio pratico
Una soluzione reale con due componenti A e B ha un processo di formazione endotermico (assorbimento del calore).
Quindi, la sua variazione di entalpia di soluzione è positiva.
$$ \Delta H_{sol} > 0 $$
Questo vuol dire che il contenuto entalpico (calore) è maggiore quando i componenti puri A e B sono mescolati nella soluzione AB.
Il maggiore calore nella soluzione AB accelera il moto delle particelle che, a sua volta, aumenta la probabilità delle particelle di passare dalla fase liquida alla fase vapore.
E questo aumenta la tensione di vapore (pressione) della soluzione.
Per questa ragione si verifica una deviazione positiva sulla curva delle tensioni di vapore della soluzione.
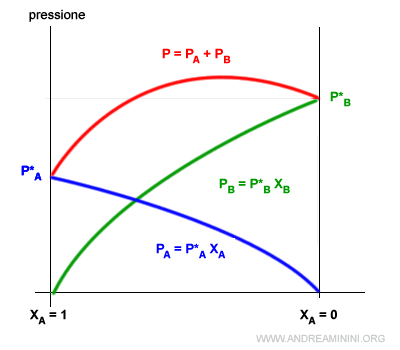
Le tensioni di vapore dei componenti A e B sono più alte quando sono mescolate tra loro, rispetto a una soluzione ideale.
In una soluzione in cui la variazione di entalpia è positiva (endotermica) si forma un azeotropo in corrispondenza al valore minimo della temperatura di ebollizione.
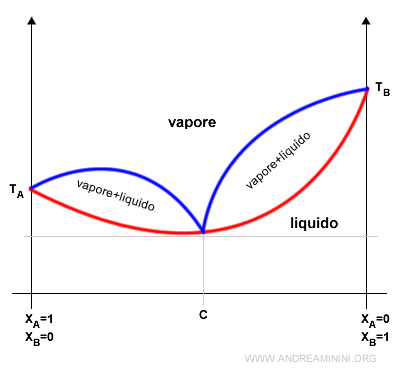
Nota. La curva rossa indica l'equilibrio dinamico in fase liquida mentre la curva blu l'equilibrio dinamico in fase vapore. Nella zona intermedia la soluzione è sia in fase liquida che in fase vapore.
Nel punto C la frazione molare dei componenti raggiunge un azeotropo.
In questo punto la composizione del liquido e del vapore è uguale. Inoltre, la soluzione raggiunge la temperatura di ebollizione minima.
Nella composizione azeotropica C i componenti non possono essere separati per distillazione.
Esempio 2
Una soluzione reale con due componenti A e B ha un processo di formazione esotermico (rilascio calore).
Quindi, la sua variazione di entalpia di soluzione è negativa.
$$ \Delta H_{sol} < 0 $$
Questo vuol dire che il contenuto entalpico (calore) è minore quando i componenti puri A e B sono mescolati tra loro nella soluzione AB.
Il minore calore nella soluzione AB rallenta il moto delle particelle che, a sua volta, riduce la probabilità delle particelle di passare dalla fase liquida alla fase vapore.
E questo riduce la tensione di vapore (pressione) della soluzione.
Per questa ragione si verifica una deviazione negativa sulla curva delle tensioni di vapore della soluzione.
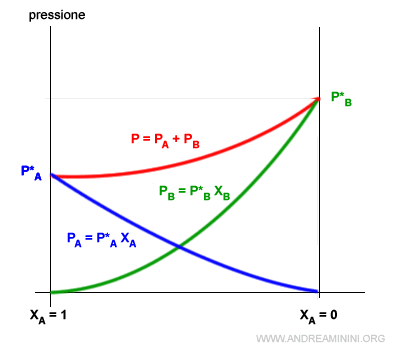
Le tensioni di vapore dei componenti A e B sono più basse quando sono mescolate tra loro, rispetto a una soluzione ideale.
In una soluzione in cui la variazione di entalpia è negativa (esotermica) si forma un azeotropo in corrispondenza al valore massimo della temperatura di ebollizione.
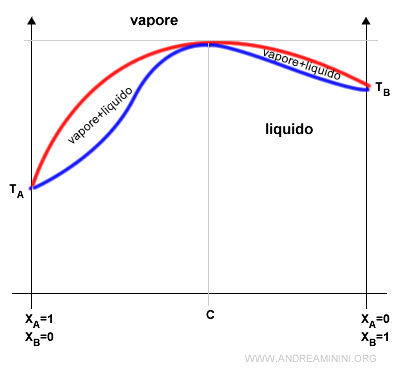
Nel punto C la frazione molare dei componenti raggiunge un azeotropo.
In questo punto la composizione del liquido e del vapore è uguale. Inoltre, la soluzione raggiunge la temperatura di ebollizione massima.
Anche in questo caso, nella composizione azeotropica C i componenti non possono essere separati per distillazione.
E così via.
