La tensione superficiale
Cos'è la tensione superficiale
La tensione superficiale è una forza di coesione delle particelle che si verifica sulla superficie di un liquido. Le molecole sulla superficie di un liquido sono attratte verso l'interno, causando la compressione della massa del liquido.
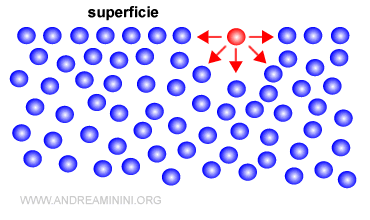
Perché si verifica?
Il fenomeno della tensione superficiale è dovuto alla differenza di comportamento delle particelle sulla superficie rispetto a quelle all'interno di liquido
- Le particelle all'interno del liquido formano legami intermolecolari in ogni direzione. Pertanto, le forze si bilanciano.
- Le particelle sulla superficie del liquido formano legami intermolecolari solo ai lati e verso l'interno. Le forze non sono bilanciate.
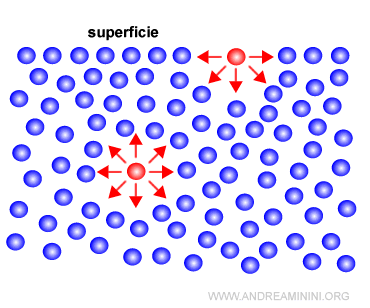
Le interazioni intermolecolari sulla superficie non sono bilanciate perché sono assenti sul lato superiore.
Quindi, le molecole superficiali sono attratte verso la parte interna del liquido.
Nota. Per questa ragione la superficie di una goccia d'acqua è sferica. Le molecole superficiali sono "trattenute" da una forza attrattiva verso l'interno del liquido. Se non ci fosse la tensione superficiale, le molecole si disperderebbero sul piano in un sottile strato molecolare.
La relazione tra tensione superficiale e temperatura
La tensione superficiale è inversamente correlata alla temperatura. Se la temperatura aumenta, la tensione superficiale si riduce. E viceversa.
Quando la temperatura sale, il calore aumenta l'energia cinetica delle particelle del liquido.
Quindi, le particelle si muovono più velocemente.
La forza di coesione delle particelle verso l'interno del liquido (tensione superficiale) viene vinta dal maggiore moto delle particelle.
Nota. Se la temperatura si abbassa, invece, le particelle riducono la velocità del moto nel liquido. Pertanto, sono maggiormente soggette alle forze intermolecolari e la tensione superficiale aumenta.
La capillarità
La capillarità è un fenomeno connesso alla tensione superficiale del liquido. Le molecole di un liquido tendono a spostarsi lungo le pareti di un tubo di vetro di dimensioni molto piccole (capillare) immerso nel liquido, a causa della coesione e dell'aderenza tra le molecole.
La differenza tra coesione e adesione
La coesione e l'adesione sono due forze intermolecolari di attrazione tra le particelle di un liquido.
- La coesione è una forza intermolecolare di attrazione tra molecole uguali. Ad esempio tra le molecole d'acqua.
- L'adesione è una forza intermolecolare di attrazione tra molecole diverse. Ad esempio, tra le molecole d'acqua e le molecole del recipiente.
Un esempio pratico
Prendo un tubo di vetro di piccole dimensioni e lo immergo in un liquido.
Se l'adesione è più forte della coesione, il liquido risale di più lungo le pareti del tubo per azione capillare.
Le molecole a contatto con le pareti del tubo trascinano dietro di sé le altre molecole del liquido. E' il caso dell'acqua.
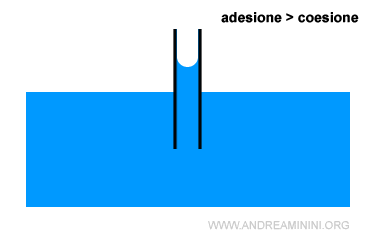
Nota. La superficie del liquido nel capillare non è piatta ma curva (menisco). E' una curva concava perché l'adesione prevale sulla coesione. La forza di adesone si riduce man mano che ci si allontana dalle pareti del capillare.
Se la coesione è più forte dell'adesione, il liquido risale meno lungo le pareti del tubo.
La coesione tra le molecole ostacola la forza di adesione delle molecole a contatto con le pareti. E' il caso del mercurio.
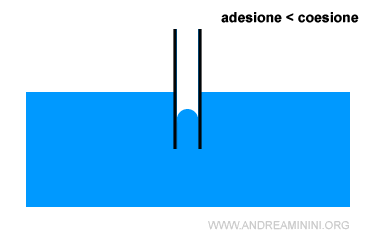
Nota. Anche in questo caso la superficie del liquido nel capillare non è piatta ma curva (menisco). Si tratta però di una curva convessa perché la forza di coesione tra le molecole è più forte e prevale sulla forza di adesione. La forza di coesione si riduce lungo le pareti del capillare per effetto dell'adesione.
E così via.
