I legami π (pi greco)
In una molecola i legami π (pi greco) sono legami chimici tra gli elettroni di atomi diversi mediante la sovrapposizione degli orbitali py e pz.
Nei legami π la sovrapposizione degli orbitali avviene sopra o sotto l'asse che congiunge i due nuclei atomici.
In questo caso la densità elettronica si concentra sopra o sotto l'asse congiungente i nuclei. Per questa ragione, il legame π è detto legame "laterale".
Un esempio pratico
Esempio 1
Questo legame π è composto dalla sovrapposizione di due orbitali di tipo py.
La sovrapposizione si trova sopra e/o sotto l'asse congiungente dei nuclei atomici.
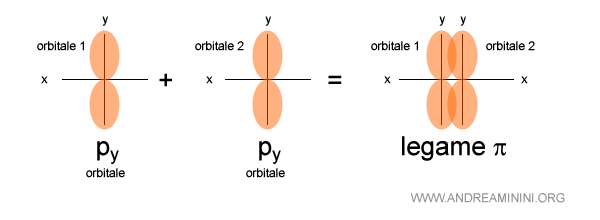
Nota. Per semplicità non ho rappresentato l'asse z. Il significato della sovrapposizione geometrica deve considerarsi nello spazio a tre dimensioni. Quindi, il legame π può avvenire anche tra orbitali pz.
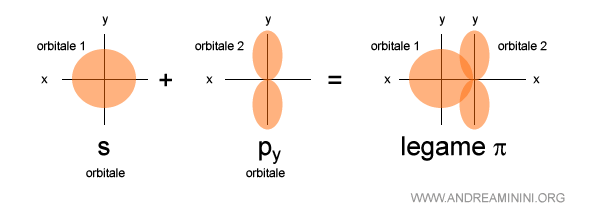
Esempio 2
Questo legame è formato dalla sovrapposizione di un orbitale s con un orbitale py.
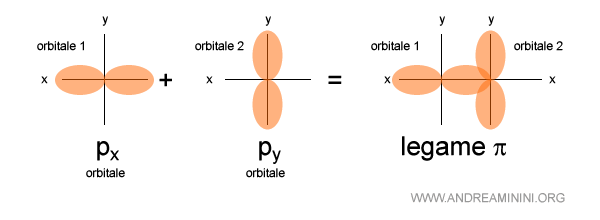
Esempio 3
Questo legame è formato dalla sovrapposizione di un orbitale px e un orbitale py.
Le caratteristiche del legame π
Il legame π è meno esteso del legame σ (sigma), quindi il legame π è più debole del legame σ.
Se due atomi condividono due o più coppie di elettroni, la prima coppia forma un legame σ mentre le altre formano dei legami π.
Nota. Quando due atomi condividono una sola coppia di elettroni, questo è sicuramente un legame semplice di tipo σ e non π.
Quindi, un legame pi si verifica soltanto in presenza di legami multipli ed esiste solo in presenza di un legame sigma.
Pertanto, il legame pi è la causa dell'esistenza dei doppi legami e, più in generale, dei legami multipli.
E così via.
