LCAO Linear Combination of Atomic Orbitals
Il metodo LCAO (Linear Combination of Atomic Orbitals) spiega la formazione degli orbitali molecolari tramite la combinazione lineare degli orbitali atomici.
Un orbitale atomico è una funzione matematica d'onda ψ che individua una regione dello spazio intorno al nucleo in cui è molto probabile trovare l'elettrone.
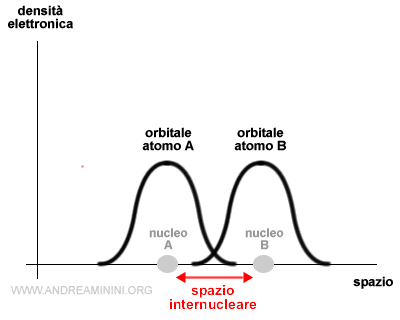
Quando due atomi sono infinitamente distanti, le rispettive funzioni d'onda ψA e ψB sono indipendenti e distinte tra loro.
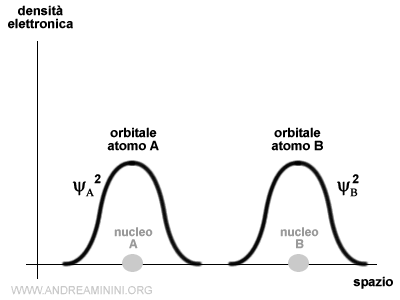
Nota. Le curve indicano la probabilità di trovare l'elettrone nello spazio intorno al nucleo atomico.
Quando gli atomi si avvicinano, gli elettroni cominciano a interagire con le forze elettrostatiche dell'altro atomo e le funzioni d'onda ψA e ψB cambiano.
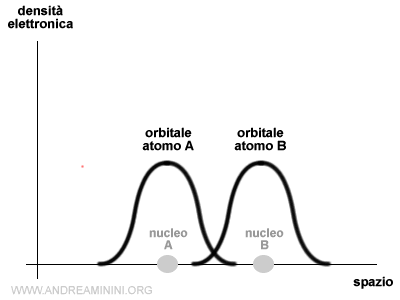
In questo caso la regione dello spazio in cui può trovarsi un elettrone è determinata dalla combinazione lineare dei due orbitali atomici.
$$ ψ = N(c_A ψ_A + c_B ψ_B) $$
Dove cA e cB sono i coefficienti della combinazione lineare necessari per minimizzare il livello di energia dell'orbitale.
Nota. I coefficienti dipendono dalle caratteristiche degli atomi. Pertanto, quando gli atomi sono uguali anche i coefficienti sono uguali. Quando sono diversi l'atomo è più elettronegativo ha coefficiente maggiore rispetto all'altro negli orbitali di legame e più basso negli orbitali di anti-legame. Pertanto, contribuisce a creare un legame più forte.
N è una costante di normalizzazione usata per fare in modo che la probabilità di trovare l'elettrone (ψ2) nello spazio sia pari a 1 (ossia 100%).
$$ \inf ψ^2 \:dV = 1 $$
La combinazione lineare di due orbitali atomici genera due orbitali molecolari ψ+ e ψ-.
$$ ψ_+ = N \cdot c_A (ψ_A + ψ_B) $$
$$ ψ_- = N \cdot c_A (ψ_A - ψ_B) $$
Ogni orbitale molecolare definisce una regione dello spazio della molecola e non solo di un singolo atomo.
La probabilità di trovare l'elettrone nella regione di spazio dell'orbitale molecolare ψ+ è pari al quadrato della funzione d'onda. Lo stesso vale per l'orbitale ψ-.
$$ ψ^2_+ = [N c_A (ψ_A+ψ_B)]^2 $$
$$ ψ^2_- = [N c_A (ψ_A+ψ_B)]^2 $$
Sviluppando il quadrato al secondo membro ottengo
$$ ψ^2_+ = N^2c_A^2 [ψ_A + 2ψ_Aψ_B + ψ_B] $$
$$ ψ^2_- = N^2c_A^2 [ψ_A - 2ψ_Aψ_B + ψ_B] $$
Il termine ψA individua la regione intorno all'atomo A isolato mentre il termine ψB la regione intorno all'atomo B isolato.
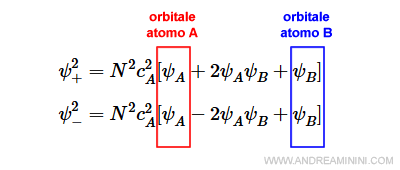
Il termine intermedio 2ψAψB è, invece, è la regione internucleare ottenuta dall'interazione degli orbitali atomici.
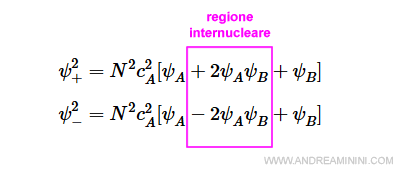
Quest'ultimo termine agisce in modo diverso negli orbitali molecolari ψ+ e ψ-.
In particolar modo nello spazio internucleare.
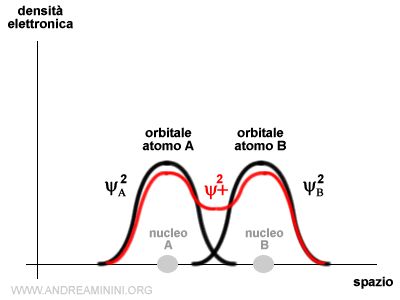
Nell'orbitale ψ+ ha segno positivo (+2ψAψB) e aumenta la densità elettronica nello spazio internucleare.
La distribuzione della probabilità di trovare l'elettrone comprende anche lo spazio tra i nuclei atomici.
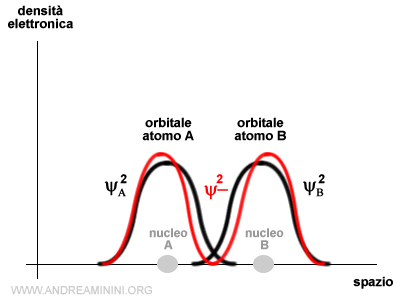
Nell'orbitale ψ- ha segno positivo (-2ψAψB) e riduce la densità elettronica nello spazio internucleare rispetto alla somma dei due orbitali atomici degli atomi isolati ψA+ψB.
In questo caso la distribuzione della probabilità di trovare l'elettrone esclude lo spazio tra i nuclei atomici.
E così via.
