La carica formale degli atomi
Cos'è la carica formale
La carica formale (CF) è la differenza tra il numero di elettroni di valenza (NI) di un atomo neutro isolato e quello degli elettroni nell'atomo legato in una molecola (NL). $$ CF= NI - NL $$
Dove NL è composto dal numero delle coppie solitarie di elettroni dell'atomo e metà delle coppie di legame dell'atomo nella molecola.

La carica formale di un atomo legato può essere
- Negativa (CF<0)
se il numero degli elettroni di valenza dell'atomo legato è maggiore rispetto all'atomo neutro isolato - Positiva (CF>0)
se il numero degli elettroni di valenza dell'atomo legato è minore rispetto all'atomo neutro isolato
In una molecola neutra la somma delle cariche formali deve essere pari a zero.
Viceversa, in uno ione la somma delle cariche formali è uguale alla carica dello ione.
Nota. Il valore della carica formale di un elemento chimico varia a seconda della formula e della struttura chimica che si prende in considerazione.
A cosa serve la carica formale?
La carica formale è un'informazione utile che mi permette di capire qual è la struttura chimica di una molecola quando esistono più strutture equivalenti.
Esempio. Se un atomo ha un'elevata elettronegativa in una molecola, è improbabile che abbia carica formale positiva. Viceversa, se un atomo ha una bassa elettronegatività è improbabile che abbia carica formale negativa.
Se una molecola è neutra, la somma delle cariche formali degli atomi che la compongono deve essere nulla.
Esempio. La molecola N2O è neutra. Quindi, la somma delle cariche formali è nulla 0+1-1=0.
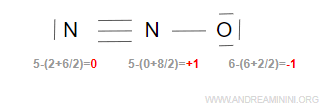
Se la somma non fosse nulla, la struttura chimica sarebbe errata. Ad esempio, questa struttura chimica è errata perché la somma delle cariche formali è diversa da zero -2+0+1=-1, il che è impossibile se la molecola è neutra.
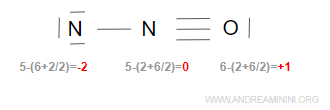
Inoltre, generalmente, la carica formale non è un valore intero molto alto. E' un altro aspetto pratico da tenere a mente.
Un esempio pratico
La molecola N2O è composta da due atomi di azoto (N) e un atomo di ossigeno (O).
L'azoto ha 5 elettroni di valenza mentre l'ossigeno ha 6 elettroni di valenza.
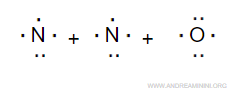
Complessivamente, nella molecola ci sono 16 elettroni di valenza.
$$ (5 \cdot 2 ) + 6 = 16 $$
Essendoci tre atomi, per completare l'ottetto sono necessari 24 elettroni di valenza.
$$ (8 \cdot 2 ) + 8 = 24 $$
Quindi, la molecola ha 4 legami chimici.
$$ \frac{24 - 16}{2} = 4 $$
Posso scrivere la molecola NO2 in queste forme.
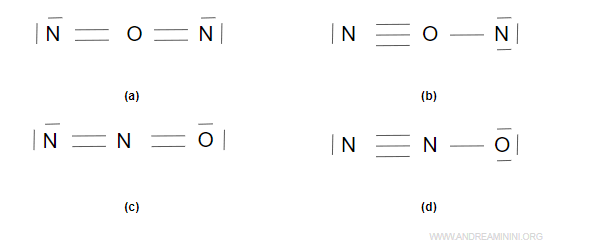
Qual è quella corretta? Tutte soddisfano la regola dell'ottetto. Per saperlo devo svolgere un'analisi più approfondita.
Calcolo la carica formale (CF) degli atomi nelle molecole. La indico in rosso.
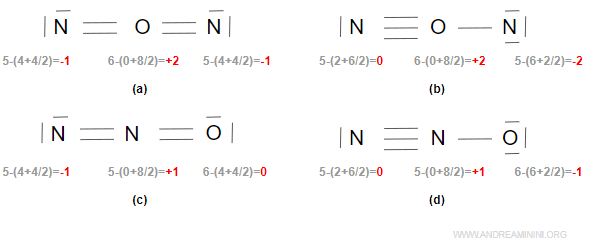
Sono tutte neutre. Tuttavia, la carica formale mi permette di capire che la prima (a) e la seconda struttura (b) sono errate, perché l'ossigeno è più elettronegativo (3.44) rispetto all'azoto (3.04).
Essendo più elettronegativo, dovrebbe attirare gli elettroni. Non può avere carica formale positiva.
Questo mi permette di escludere le strutture (a) e (b) dove l'atomo di ossigeno ha carica formale positiva +2.
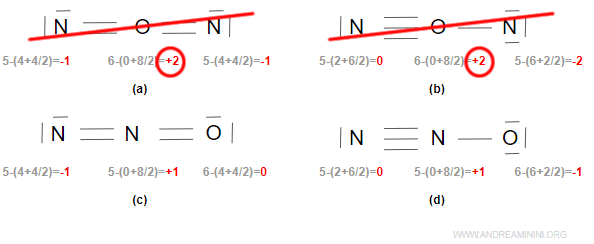
Restando due strutture possibili dove l'atomo di ossigeno ha carica nulla (c) e carica negativa (d).
L'ultima struttura chimica è quella più probabile anche se la terza struttura non può essere scartata del tutto.
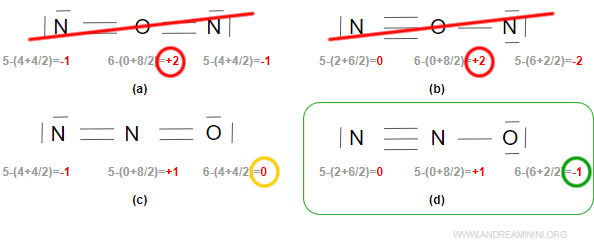
Nota. Se due strutture soddisfano entrambe le condizioni di elettronegatività, è molto probabile che ci si trovi in una situazione di risonanza chimica.
E così via.
