Gas reali
Cosa sono i gas reali
I gas reali sono gas che manifestano un comportamento diverso rispetto ai gas ideali (o gas perfetti). Ai gas reali non è possibile applicare le leggi dei gas ideali.
Perché si chiamano gas reali?
Gran parte dei gas hanno un comportamento simile ai gas ideali a condizioni ambientali, quando la temperatura è 0°C e la pressione è 1 atmosfera.
A pressioni più elevate e temperature più basse, il comportamento "reale" dei gas diverge da quello dei gas ideali, perché il volume delle molecole e le interazioni intermolecolari non più trascurabili.
Questi gas sono detti gas reali.
Nota. Il comportamento di un gas reale si avvicina a quello del gas ideale quando la temperatura è molto alta e la pressione è molto bassa. In queste condizioni ambientali le particelle del gas si muovono più velocemente e sono meno vicine tra loro, rendendo trascurabili le forze attrattive intermolecolari.
Quali sono le caratteristiche dei gas reali
Il volume delle molecole del gas reale non è più trascurabile.
Se si considera il volume delle molecole, lo spazio libero a disposizione del recipiente in cui le molecole possono muoversi si riduce.
Pertanto, il volume di un gas reale è inferiore rispetto a un gas ideale.
Nota. Le molecole di un gas ideale sono puntiformi per definizione, ossia prive di volume proprio.
Inoltre, a differenza dei gas ideali, nei gas reali le interazioni tra le molecole sono possibili.
La forza di attrazione tra le molecole del gas prevale su quella repulsiva perché le sostanze gassose sono sufficientemente lontane, se la pressione non è eccessivamente alta.
Quindi, le molecole attraggono quelle più vicine in ogni direzione.
Ne consegue che in un gas reale la pressione sulle pareti del recipiente è più bassa, perché la forza di attrazione intermolecolare genera una pressione interna, ossia una pressione verso l'interno che riduce la pressione verso l'esterno.
Cos'è la pressione interna? Quando le molecole del gas urtano sulle pareti del recipiente sono trattenute parzialmente dalla forza di attrazione delle molecole interne più vicine. Quindi, la pressione del gas reale sulla parete del recipiente è minore rispetto a un gas ideale.
Il fattore di compressibilità del gas reale
Ogni gas reale è caratterizzato da un fattore di compressibilità (o comprimibilità) pari al seguente rapporto $$ \frac{PV}{RT} $$ Dove P è la pressione, V il volume, R la costante universale dei gas e T la temperatura.
Il fattore di comprimibilità pari a 1 è caratteristico dei gas ideali.
Nota. Nell'equazione di stato dei gas, una mole di gas ideale è pari a $$ PV = RT $$ E' subito evidente che in un gas ideale il rapporto PV/RT è un valore costante pari a 1. $$ \frac{PV}{RT} = 1 $$
Nei gas reali, invece, la comprimibilità dei gas varia in funzione della pressione e della natura chimica del gas.
In base al fattore di compribilità i gas reali si classificano in
- Gas incoercibili
Sono gas reali in cui il fattore di compressibilità PV/RT cresce con la pressione. $$ \frac{PV}{RT} \gt 1 $$Nota. Quindi, a parità di pressione P e temperatura T, il volume di un gas reale incoercibile è sempre maggiore di un gas ideale.
- Gas coercibili
Sono gas reali in cui il fattore di compressibilità PV/RT è correlato inversamente quando la pressione è bassa e correlato direttamente alla pressione quando è alta. $$ \begin{cases} \frac{PV}{RT} \le 1 \:\:\: se \: P<P_x \\ \\ \frac{PV}{RT} \ge 1 \:\:\: se \: P>P_x \end{cases} $$
La rappresentazione grafica della relazione tra il fattore di compressibilità e la pressione nei gas reali incoercibil, coercibili e nei gas ideali.
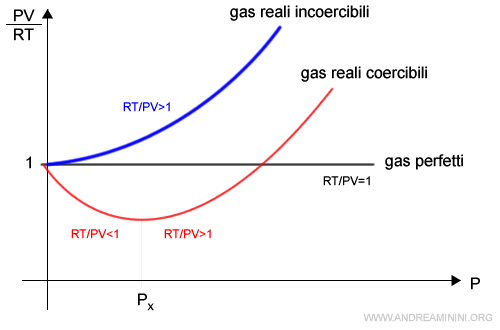
Nota. Soltanto quando la pressione è molto bassa, i gas reali si comportano come i gas ideali e il fattore di compressibilità (PV/RT) è pari a 1.
E così via.
