Eccezioni alla regola dell'ottetto
La regola dell'ottetto non è sempre applicabile. Esistono diversi composti chimici in cui non è soddisfatta.
Le molecole con un numero dispari di elettroni hanno un ottetto incompleto.
Un esempio pratico
L'ossido di azoto (NO) è composto da un atomo di azoto (N) e un atomo di ossigeno (O).
Gli elettroni di valenza sono 5+6 ossia 11.
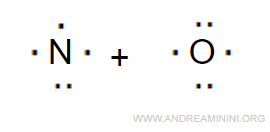
Per essere soddisfatto l'ottetto in entrambi gli atomi dovrebbero esserci 8+8 = 16 elettroni.
Quindi, i legami chimici sono
$$ \frac{16-11}{2} = \frac{5}{2} $$
Poiché il valore reale 2.5 non è ammissibile per definire le coppie di legame, prendo il valore intero 2.
Pertanto, si formano 2 coppie di legame.
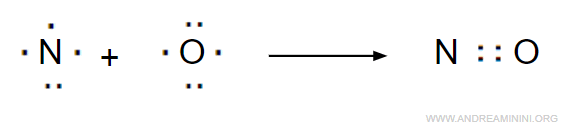
Tolti i quattro elettroni delle coppie di legame, gli elettroni restanti sono 11-4 = 7, di cui 4 sono dell'atomo di ossigeno e 3 sono dell'atomo di azoto.
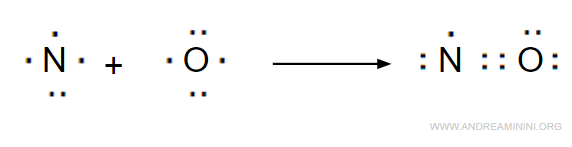
Quindi, nella molecola l'ossigeno completa l'ottetto mentre l'atomo di azoto ha soltanto 7 elettroni.
Pertanto l'atomo di azoto si lega ma non completa l'ottetto.
Altre eccezioni. Diversi elementi dei gruppi II A (berillio) e III A (boro e alluminio) si legano in molecole senza completare l'ottetto. Generalmente gli elementi non metallici, invece, rispettano la regola dell'ottetto.
L'espansione dell'ottetto
L'espansione dell'ottetto si verifica nelle molecole in cui alcuni atomi hanno più di otto elettroni di valenza.
E' frequente in alcuni composti dove si presenta un atomo di fosforo (P), zolfo (S) o iodio (I).
Può capitare che un atomo in una molecola abbia 10, 12 o 14 elettroni.
Un esempio pratico
Nella molecola SF6 l'atomo di zolfo (S) si colloca al centro della struttura con sei coppie di legame verso gli atomi di fluoro (F).
Gli atomi di fluoro (F) soddisfano la regola dell'ottetto.
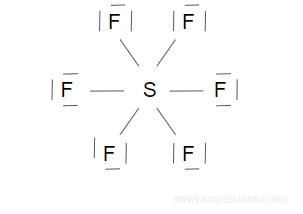
L'atomo di zolfo (S), invece, ha ben 12 elettroni a causa delle sei coppie di legame.
E' un esempio pratico di espansione dell'ottetto.
L'espansione dell'ottetto per sollecitazione degli elettroni
L'espansione dell'ottetto può verificarsi anche se un elettrone delle coppie negli orbitali s oppure p si sposti su un orbitale di tipo d (o comunque di livello superiore) a causa di una sollecitazione esterna.
In questo modo, l'atomo può formare più legami chimici.
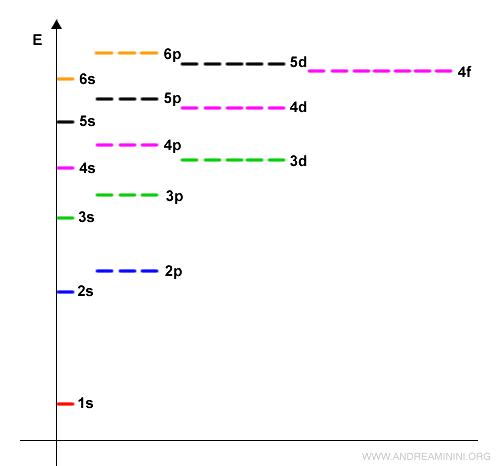
Questo accade soprattutto se gli orbitali hanno livelli di energia non sono troppo lontani tra loro.
Ad esempio, l'atomo di fosforo ha cinque elettroni di valenza, due nell'orbitale 3s e tre elettroni spaiati negli orbitali 3p.
$$ 3s^2 \: 3p^3 $$
Quindi può formare tre coppie di legame con altri atomi.
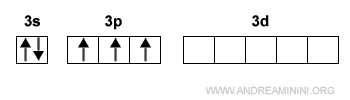
Se l'atomo riceve energia dall'esterno, un elettrone nell'orbitale 3s si sposta sull'orbitale 3d.
In questa configurazione l'atomo di fosforo può formare cinque legami con altri atomi.
E così via.
